氯气(Cl2)是黄绿色气体,其水溶液叫氯水。把品红试纸(染有品红的纸)伸入氯水中,品红褪色。请回答下列各题。
【发现问题】 氯水中的哪些成分能使品红褪色呢?
【查阅资料】 氯气溶于水,部分与水反应,方程式为Cl2 + H2O =" HCl" + HClO。其中,HClO的名称叫次氯酸,是一种弱酸,具有强氧化性。
【猜 想】猜想1:是氯水中的水使品红褪色的;
猜想2:是氯水中的氯气使品红褪色的;
猜想3:是氯水中的盐酸使品红褪色的;
猜想4:是氯水中的次氯酸使品红褪色的。
【实验探究】
| 实 验 操 作 |
实验现象 |
过程分析 |
| ①把品红试纸伸入水中 |
没有褪色 |
猜想1不成立 |
| ②把品红试纸伸入干燥的氯气中 |
没有褪色 |
猜想2不成立 |
| ③ |
没有褪色 |
猜想3不成立 |
【结 论】
综合分析:氯水中的 (填化学式)使品红褪色,具有漂白作用(能使品红等有色物质褪色)。
【反 思】HClO中氯元素的化合价为 价。
小科同学将一片土豆放入过氧化氢溶液中,发现过氧化氢溶液的分解速度加快。查阅资料后她知道土豆中含有过氧化氢酶,这是一种生物催化剂。于是她设计了如下实验:常温下将几片土豆放入甲注射器,分别往甲、乙两注射器内注入相同体积与溶质质量分数的过氧化氢溶液(如同所示),密封后观察注射器内气泡产生的速率。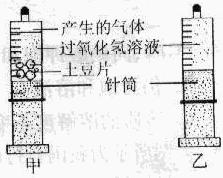
(1)小科设计的乙装置起作用。
(2)小科把甲注射器放在0℃的环境中,发现产生气体的速率减小,说明过氧化氢酶的催化效率与有关。
为测定空气中氧气的含量,小华同学打算设计如下方案:选用实际容积为40 mL的试管作反应容器,将过量的白磷放入试管,用橡皮塞塞紧试管,通过导管与实际容积为60 mL且润滑性很好的针筒注射器组成如图的实验装置。假设此实验能够按照小华的设想正常进行,且白磷所占体积与导管内的气体体积忽略不计,请回答下列问题: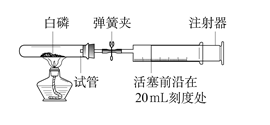
(1)实验前,打开弹簧夹,将注射器活塞前沿从20 mL刻度处推至15 mL刻度处,然后松开手,若活塞仍能返回至20 mL刻度处,则说明;
(2)若先夹紧弹簧夹,用酒精灯加热白磷,燃烧结束,等到试管冷却后再松开弹簧夹。可观察到的现象为;
(3)若不使用弹簧夹,用酒精灯加热白磷,充分反应直至燃烧结束,试管冷却。可观察到的现象为___________________________________________;
(4)若按小华的设想进行实验,实际可能遇到诸多问题而发生危险,造成实验失败。例如:_________________________________________________。
用来测定空气成分的方法很多,如图所示的是小明用红磷在空气中燃烧的测定方法。实验过程是: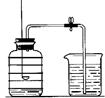
第一步:将集气瓶容积划分为五等份,并做好标记。
第二步:点燃燃烧匙内的红磷,伸入集气瓶中并把塞子塞紧。
第三步:待红磷熄灭并冷却后,打开弹簧夹,发现水被吸入集气瓶中,进入集气瓶中水的体积约为集气瓶总容积的1/5。请回答下列问题:
(1)上面的实验同时证明了氮气有的化学性质。
(2)实验完毕,若进入集气瓶中水的体积不到总容积的1/5,你认为导致这一结果的原因可能是。
(3)第二步中发生反应的文字表达式为________________________________。
(4)某同学对实验进行反思后,提出了改进方法(如图所示 ),你认为改进后的优点是:。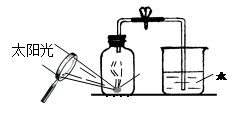

请你帮助小林同学完成“探究碱式碳酸铜(铜绿)的性质”实验的报告:
[实验目的]探究铜绿的性质
[实验用品]略
[实验过程及现象记录]
(1)观察铜绿的颜色和状态等物理性质:铜绿是绿色粉末状固体。
(2)用药匙或纸槽分别取少量铜绿于两支试管中
(3)然后用胶头滴管向其中一支试管中逐滴滴加稀盐酸,观察到铜绿逐渐溶解,产生大量_____,并形成蓝色溶液
(4)将另一支试管在酒精灯上加热,一段时间后,观察到固体粉末逐渐变成____色,且试管壁有水雾出现,若把产生的气体通入澄清石灰水中,石灰水会变浑浊。
[实验结论]铜绿具有的化学性质是:
(1)铜绿能与_____________反应;
(2)铜绿受热易分解,由分解的产物可推断出铜绿是铜在空气中与______、_______、_______等发生复杂的化学变化生成的。
为了研究质量守恒定律,设计了右图“白磷燃烧前后质量测定”的实验,请分析有关问题: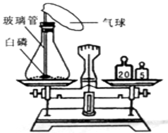
(1)装置:锥形瓶的底部铺有一层细沙,其作用是.
(2)燃烧前称量,锥形瓶的总质量为27.6g,则右图托盘天平中游码的读数为 g.
(3)白磷燃烧:白磷燃烧过程中看到的现象是 .
(4)燃烧后称量:发现托盘天平指针偏向右边,造成的原因可能是
(5)反思:白磷燃烧 (填“遵守”或“不遵守”)质量守恒定律,理由是 .