在一定条件下,某些化学反应可以下图框架表示,根据要求回答下列问题:
(1)若A、C、D均为含氯物质,且A的化合价介于C和D之间,D具有漂白性,写出该反应的离子方程式 ;
(2)若通过电解的方法获得黄绿色气体C,则该反应的离子方程式为
(3)若C、D均为气体且均能使澄清石灰水变浑浊,写出符合上述框图要求的化学方程式
(4)若A为红色金属单质,B为第二周期某种元素的最高价氧化物的水化物的稀溶液,
写出符合上述框图关系的离子方程式 。
工业上,可以由下列反应合成三聚氰胺:
CaO+3C CaC2+CO↑;CaC2+N2
CaC2+CO↑;CaC2+N2 CaCN2+C;CaCN2+2H2O=NH2CN+Ca(OH)2
CaCN2+C;CaCN2+2H2O=NH2CN+Ca(OH)2
NH2CN与水反应生成尿素[CO(NH2)2],再由尿素合成三聚氰胺。
(1)写出与Ca在同一周期的Cu原子的基态电子排布式。
(2)写出CaC2中阴离子C22-的一种等电子体的化学式。
(3)1mol 尿素分子[CO(NH2)2]中含有的π键与σ键的数目之比为。
(4)三聚氰胺俗称“蛋白精”,其结构为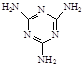 。其中氮原子的杂化方式有。
。其中氮原子的杂化方式有。
(5)CaO晶胞如下图所示,CaO晶体中与O2-距离最近的O2-的个数为。CaO晶体的熔点比NaCl晶体的熔点高的主要原因是。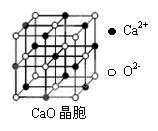
金属单质及其化合物与工农业生产、日常生活有密切的联系。请回答下列问题:
(1)一定条件下,用Fe2O3、NiO或Cr2O3作催化剂,利用如下反应回收燃煤烟气中的硫。反应为:2CO(g)+SO2(g) 2CO2(g)+S(l)△H=-270kJ∙mol-1
2CO2(g)+S(l)△H=-270kJ∙mol-1
其他条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图1,不考虑催化剂的价格因素,选择为该反应的催化剂较为合理。(选填序号)
a.Cr2O3b.NiOc.Fe2O3
选择该催化剂的理由是:。
某科研小组用选择的催化剂,在380℃时,研究了n(CO) : n(SO2)分别为1:1、3:1时,SO2转化率的变化情况(图2)。则图2中表示n(CO) : n(SO2)=3:1的变化曲线为。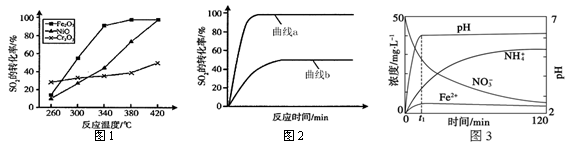
(2)科研小组研究利用铁屑除去地下水中NO3-的反应原理。
①pH=2.5时,用铁粉还原KNO3溶液,相关离子浓度、pH随时间的变化关系如图3(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前发生反应的离子方程式;t1时刻后,反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有明显变化,可能的原因是。
②若在①的反应中加入活性炭,可以提高除去NO3-的效果,其原因可能是。正常地下水中含有CO32-,会影响效果,其原因有:a.生成FeCO3沉淀覆盖在反应物的表面,阻止了反应的进行;b.。
(3)LiFePO4电池具有稳定性高、安全、环保等优点,可用于电动汽车。电池反应为:FePO4+Li LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。放电时电池正极反应为。
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。放电时电池正极反应为。
(1)联氨(N2H4)是一种高能燃料。工业上可以利用氮气和氢气制备联氨。
已知:N2(g)+2H2(g)=N2H4(l) △H=" +" 50.6kJ·mol-1; 2H2(g)+O2(g)=2H2O(l) △H="-571.6" kJ·mol-1
则①N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=kJ·mol-1
②N2(g)+2H2(g)=N2H4(l) 不能自发进行的原因是。
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是。
(2)在纳米钴的催化作用下,N2H4可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,则N2H4发生分解反应的化学方程式为。
(3)N2H4与亚硝酸反应可生成氮的另一种氢化物,在标准状况下,该氢化物气体的相对分子质量为43.0,其中氮原子的质量分数为0.977。该氢化物受撞击后可完全分解为两种单质气体。该氢化物分解的化学方程式为。
(4)氨氧化法制硝酸工业尾气中的NO、NO2气体可用氨水吸收,反应方程式为6NO+4NH3===5N2十6H2O,6NO2+8NH3===7N2+12H2O。若尾气中NO和NO2共18 mol被氨水完全吸收后,产生了15.6 mol N2,则此尾气中NO与NO2的体积比为。
(1)室温下,Ksp(BaSO4)=1.1×10-10,将pH=9 的 Ba(OH)2溶液与 pH=4 的 H2SO4溶液混合,若所得混合溶液的 pH=7,则 Ba(OH)2溶液与 H2SO4溶液的体积比为。欲使溶液中c(SO42-)≤1.0×10-5mol·L-1,则应保持溶液中 c(Ba2+) ≥mol·L-1。
(2)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 molCH3COONa固体,则醋酸的电离平衡向(填“正”或“逆”)反应方向移动;溶液中 的值(填“增大”、“减小”或“不变”)。
的值(填“增大”、“减小”或“不变”)。
(3)已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5
b.CH3COOH+NaHCO3 = CH3COONa+CO2↑+H2O 室温下,CH3COONH4溶液呈性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈性。NH4HCO3溶液中物质的量浓度最大的离子是(填化学式)。
300℃时,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应:
X(g) +Y(g) 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
| t/min |
2 |
4 |
7 |
9 |
| n(Y)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
回答下列问题:
(1)反应0~2 min Z的平均速率v(Z)=
(2)能判断该反应已经达到平衡状态的是
A.生成X的速率是生成Z的速率的2倍
B.容器内压强保持不变
C.容器内气体的密度保持不变
D.容器内各气体的浓度保持不变
(3)要提高上述反应的转化率,可采取的措施是(任写一种)。
(4)温度为300℃时,该反应的化学平衡常数K=
(5)若起始时向该容器中充入X、Y、Z各0.20 mol,则反应将向(填“正”或“逆”)反应方向进行,达平衡时Z的体积分数与上述平衡相比(填“增大”、“减小”或“不变”)