完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是
| |
A |
B |
C |
D |
| 实 验 |
用CCl4提取 溴水中的Br2 |
除去乙醇中的I2 |
加热分解MgCl2.6H2O得到纯净的MgCl2 |
配制100 mL 0.1000 mol·L-1 K2Cr2O7溶液 |
| 装 置 或 仪 器 |
 |
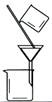 |
 |
 |
某小组为研究电化学原理,设计如图2装置。下列叙述不正确的是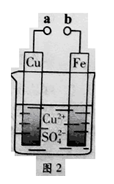
| A.a和b不连接时,铁片上会有金属铜析出 |
| B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu |
| C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
| D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动 |
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水” 电池在海水中放电时的有关说法正确的是:
| A.正极反应式:Ag+Cl--e-="AgCl" | B.每生成1 mol Na2Mn5O10转移2 mol电子 |
| C.Na+不断向“水”电池的负极移动 | D.AgCl是还原产物 |
Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为: 2Li++FeS+2e-=Li2S+Fe有关该电池的下列叙述中,正确的是
A.Li -Al在电池中作为负极材料,该材料中Li的化合价为+1价 -Al在电池中作为负极材料,该材料中Li的化合价为+1价 |
| B.该电池的电池反应式为:2Li+FeS=Li2S+Fe |
| C.负极的电极反应式为Al-3e-=Al3+ |
D.充电时,阴极发生的电极反应式为: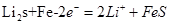 |
用铂电极电解CuCl2与CuSO4的混合溶液(浓度均为2 mol/L)50mL ,当阴极析出9.6g 固体时,阳极析出的气体在标准状况下的体积是
| A.3.36L | B.2.8L | C.6.72L | D.4.48L |
锌锰干电池在放电时电池总反应方程式可以表示为:Zn+2MnO2+2
 Zn2++Mn2O3+2NH3+H2O,在此电池放电时,正极(碳棒)上发生反应的物质是()
Zn2++Mn2O3+2NH3+H2O,在此电池放电时,正极(碳棒)上发生反应的物质是()
A.MnO2和 |
B.Zn2+和 |
C.Zn | D.碳棒 |