用R代表短周期元素,R原子最外层的p能级上的未成对电子只有2个。下列关于R的描述中正确的是( )
| A.R的氧化物都能溶于水 |
| B.R的最高价氧化物对应的水化物都是H2RO3 |
| C.R的氢化物中心原子的杂化方式都是sp3 |
| D.R的氧化物都能与NaOH反应 |
常温下用pH试纸测定某溶液的pH,如果将pH试纸用蒸馏水润湿后,再把待测液滴到pH试纸上,跟比色卡对照,测得pH=6。则此溶液的实际pH()
| A.大于6 | B.小于6 | C.等于6 | D.大于7 |
对于可逆反应:2SO2(g)+O2(g)  2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是()
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是()
| A.增大压强 | B.升高温度 | C.使用催化剂 | D.多充入O2 |
下列物质分类组合正确的是()
| A |
B |
C |
D |
|
| 强电解质 |
HBr |
FeCl3 |
H3PO4 |
Ca(OH)2 |
| 弱电解质 |
HF |
CH3COOH |
BaSO4 |
HI |
| 非电解质 |
NH3 |
Cu |
H2O |
C2H5OH |
某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应:
3A(g)+2B(g) 4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是
4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是
A.该反应的化学平衡常数表达式是K=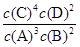 |
| B.此时,B的平衡转化率是35% |
| C.增大该体系的压强,平衡向右移动,化学平衡常数增大 |
| D.增加一定物质的量的C,B的平衡转化率不变 |
为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究。在T10C 时,将9molCO2和12molH2充入3L密闭容器中,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0,容器中CH3OH的物质的量随时间变化如右图曲线I所示,平衡时容器内压强为P。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如右图曲线II所示。下列说法正确的是
CH3OH(g)+H2O(g) ΔH<0,容器中CH3OH的物质的量随时间变化如右图曲线I所示,平衡时容器内压强为P。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如右图曲线II所示。下列说法正确的是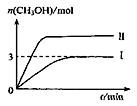
| A.曲线II对应的条件改变是减小压强 |
| B.若T2°C时,上述反应平衡常数为0.42,则T2<T1 |
| C.在T10C时,若起始时向容器中充入5 mol CO2、5 mol H2、5 mol CH3OH(g)和5 mol H2O(g),则达平衡前v(正)>v(逆) |
D.在T10C时,若起始时向容器中充入4.5molCO2、6mol H2 ,平衡时容器内压强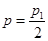 |