平衡指的是两个相反方向的变化最后所处的运动状态;在平衡时,两种变化仍在继续进行,但是它们的速率相等;根据变化的性质可分为物理平衡和化学平衡,中学阶段涉及的平衡有气体可逆反应的平衡、酸碱电离平衡、水解平衡及沉淀-溶解平衡等等。
(1)现有容积为1 L的恒温恒容密闭容器,向其中加入2 mol A气体和2 mol B气体后发生如下反应:
A(g) + B(g)  C(g) △H= - a kJ·mol-1
C(g) △H= - a kJ·mol-1
20s后,反应达到平衡状态,生成1 mol C气体,放出热量Q1kJ。回答下列问题。
①计算20s内B气体的平均化学反应速率为___________,写出该反应的平衡常数表达式___________。
②保持容器温度和容积不变,若改为向其中加入1molC气体,反应达到平衡时,吸收热量Q2kJ,则Q1 与Q2的相互关系正确的是____________(填字母)。
(A)Q1 + Q2 = a (B) Q1 + 2Q2 < 2a (C)Q1 + 2Q2 > 2a (D)Q1 + Q2 < a
③在原平衡基础上,保持容器温度和容积不变,向容器中再通入b mol A气体(b>0)时,v(正)_____v(逆)(填“>”、“<”或“=”),重新达平衡后,C气体的平衡体积分数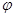 (C) =
(C) = 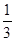 ,则b = ____________。
,则b = ____________。
(2)常温下,将VmL、0.1000mol·L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol·L-1醋酸溶液中,充分反应。回答下列问题。(忽略溶液体积的变化)
①如果溶液pH=7,此时V的取值_____20.00(填“>”、“<”或“=”),而溶液中c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为_____________________________________________。
②如果V=40.00,则此时溶液中c(OH-) - c(H+) - c(CH3COOH)= ___________________mol·L-1。
下表是元素周期表的一部分,列出了十个元素在周期表中的位置:
| 族 周期 |
IA |
IIA |
IIIA |
VIA |
VA |
VIA |
VIIA |
0 |
| 2 |
⑥ |
⑦ |
||||||
| 3 |
① |
③ |
⑤ |
⑧ |
⑩ |
|||
| 4 |
② |
④ |
⑨ |
请用化学用语回答下列问题
(1)在③~⑦元素中,原子半径最大的是 (填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是(填物质化学式),
呈两性的氢氧化物是(填物质化学式);
(3)在⑧与⑨的单质中,氧化性较强的是(填名称)。
(4)用电子式表示元素③与⑧形成化合物的过程。
(5)分别写出⑥元素的氢化物:
a.燃烧的化学方程式,
b.与氯气在光照条件下反应,生成类似甲烷分子结构(正四面体)的氯代烃的化学方程式:。
(6)写出工业冶炼⑤的化学方程式:
(7)上述哪些元素可以从海水中通过一定的方法提取: ,(填元素符号)写出将⑨元素单质从海水中(离子形式存在)提取所涉及到的化学方程式; 。
理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+ =2 Ag +Cu2+ ”设制一个化学电池(正极材料用碳棒),回答下列问题:
该电池的电解质溶液是;负极发生反应(填“氧化”或“还原”),电极反应式
有下列各组物质
| A.O2和O3 | B.12C和13C |
C.CH3—CH2—CH2—CH3和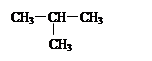 |
|
D. 和 和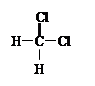 E.甲烷和庚烷 E.甲烷和庚烷 |
(1)_________组两物质互为同位素;(2)__________组两物质互为同素异形体;
(3)_________组两物质属于同系物;(4)_________组两物质互为同分异构体;
工业上测量SO2、N2、O2混合气体中SO2含量的装置如下图所示。反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O===H2SO4+2HI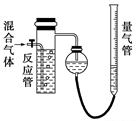
(1)混合气体进入反应管后,量气管内增加的水的体积等于________的体积(填写气体的化学式)。
(2)反应管内溶液蓝色消失后,没有及时停止通气。则测得的SO2含量________(选填“偏高”、“偏低”或“不受影响”)。
(3)反应管内的碘的淀粉溶液也可以用__________代替(填写物质名称)。
(4)若碘溶液体积为Va mL,浓度为c mol·L-1,N2与O2的体积为Vb mL(已折算为标准状况下的体积)。用c、Va、Vb表示SO2的体积百分含量为________。
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为________(选下列仪器的编号)。
a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
工业纯碱主要含有NaCl和NaHCO3杂质,为了鉴定纯碱的含量,常用酸碱滴定测定总碱度,反应产物为NaCl、CO2和H2O。当盐酸与一定工业纯碱恰好完全反应时,溶液pH 3.8~3.9(滴定时NaHCO3也被中和)。工业纯碱的总碱度测定值通常以Na2CO3%和Na2O%表示。
主要实验步骤:①准确称取工业纯碱试样2.00 g;②用适量水配制成体积一定的溶液;③准确移取一定量的所配试液,再用0.01 mol·L-1盐酸标准液滴定,测其总碱度。
请回答以下问题:
(1)称取固体工业纯碱试样时,为什么试样取尽量多些并且力求均匀?
________________________________________________________________________。
(2)在准确称取纯碱试样后,为继续进行实验,除选用烧杯、玻璃棒、酸式滴定管、碱式滴定管、锥形瓶之外。还需要的仪器用品(试剂除外)有
____________________________________________________________。
(3)在滴定操作中,应选用的指示剂是
________________________________________________________________________。
(4)假如所称取的纯碱试样中,除含有2%的NaCl外,另外的杂质中只有NaHCO3,那么NaHCO3含量的大小对该试样总碱度的测定值有何影响?
________________________________________________________________________
________________________________________________________________________。