已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为:C(金刚石、s)+O2(g)=CO2(g);△H=-395.41kJ/mol,C(石墨、s)+O2(g)=CO2(g);△H=-393.51kJ/mol,则金刚石转化石墨时的热化学方程式为:____________________________________。
由此看来更稳定的碳的同素异形体为:____________。若取金刚石和石墨混合晶体共1mol 在O2中完全燃烧,产生热量为QkJ,则金刚石和石墨的物质的量之比为_____________(用含Q的代数式表示)
[化学—选修(二)化学与技术]常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
(1)填充物用60℃温水溶解,目的是 。
(2)操作A的名称为 。
(3)铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。铜帽溶解完全后,可采用_________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为 2MnO(OH)+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有 mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该应的化学方程式: 。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:
根据上图可知:
①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率 。
②在强酸性环境下Hg的吸收率高的原因可能是KMnO4在酸性条件下 强。
发生在天津港“8·12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注。
(1)为了减少空气中SO2的排放,常采取的措施是将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)==H2O(g)ΔH1=-241.8 kJ·mol-1
C(s)+1/2O2(g)===CO(g)ΔH2=-110.5 kJ·mol-1
则焦炭与水蒸气反应生成CO的热化学方程式为: 。
(2)由于CaC2、金属钠、金属钾等物质能够跟水反应给灾后救援工作带来了很多困难。如果在实验室,你处理金属钠着火的方法是 。
(3)事故发生后,爆炸中心区、爆炸区居民楼周边以及海河等处都受到了严重的氰化物污染。处理NaCN的方法是:用NaClO在碱性条件下跟NaCN反应生成无毒害的物质,试写出该反应的离子反应方程式 。
(4)电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO3-的原理如图所示,电源正极为 (填“a”或“b”);若总反应为4NO3-+4H+=5O2↑+2N2↑+2H2O,则阴极反应式为 。
(5)欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去。已知在常温下:Ksp[Fe(OH)2]= 1×10-15、Ksp[Fe(OH)3]= 1×10-38、Ksp[Cr(OH)3]= 1×10-23,当离子浓度在1×10-5mol/L以下时认为该离子已经完全沉淀,请回答:
①相同温度下Fe(OH)3的溶解度 Cr(OH)3的溶解度(填“>”、“<”或“=”)
②浓度为0.1mol/L的Fe2+与10. 0mol/L Cr3+同时生成沉淀的pH范围是 。
(14分)氮元素能形成多种多样的化合物。请回答:
(1)298 K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g) ΔH=-a kJ/mol (a>0) 。N2O4的物质的量浓度随时间变化如下图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
N2O4(g) ΔH=-a kJ/mol (a>0) 。N2O4的物质的量浓度随时间变化如下图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
①298k时,该反应的平衡常数为 L·mol-1(精确到0.01);
②下列情况不能用来判断该反应是否处于平衡状态的是 ;
A.混合气体的密度保持不变;
B.混合气体的颜色不再变化;
C.混合气体的气体压强保持不变
③若反应在398K进行,某时刻测得n(NO2)="0.6" mol、n(N2O4)=1.2mol,则此时v(正) v(逆)(填 “>”、“<”或“=”)。
(2)常温条件下,向100 mL 0.1mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如下图所示。试分析图中a、b、c、d、e五个点(该条件下硫酸第二步电离是完全的)。
①a点溶液的pH_________1(填“>”“<”或“=”);
②b点溶液中发生水解反应的离子是____________;
③c点溶液中各离子浓度由大到小的排列顺序为 ;
④d、e点对应溶液中,水电离程度大小关系是d e(填“>”、“<”或“=”)。
金属冶炼和处理常涉及电化学反应。
(1)冶炼或冶炼提纯下列相应金属时没有采用到电解法的是
a.Fe b.Na c.Cu d.Al
(2)右图为电解精炼银的示意图, (填a或b)极为含有杂质的粗银;电解过程中,若b极伴有少量无色气体生成,在空气中变红棕色,则生成气体的电极反应式为____________________
(3)银白光亮的银器用久后表面易出现黑斑(Ag2S),为处理黑斑,将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为 。
(4)右图的装置进行电解实验:A极是铜锌合金,B极为纯铜,电解质为CuSO4溶液(足量)。通电一定时间后,A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.03g ,则A合金中Cu、Zn原子个数比为 。
天然矿物芒硝化学式为Na2SO4·10H2O,为无色晶体,易溶于水。该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念。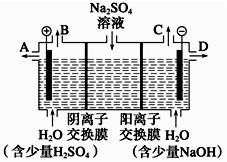
(1)该电解槽的阴极电极反应式为 。此时通过阴离子交换膜的离子数__________(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
(2)所得到的浓氢氧化钠溶液从出口(填“A”、“B”、“C”或“D”)____________导出。
(3)若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则该电池负极的电极反应式为_________。