在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是
(a)容器中压强不变 (b)混合气体中 c(CO)不变
(c)v正(H2)=v逆(H2O) (d)c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
(每空2分,共14分)A、B、C、D均为含苯环的化合物,且相对分子质量B>A>C,已知有机物A的结构简式为:
(1)A既能和NaOH溶液反应,又能和NaHCO3溶液反应,写出A和 NaHCO3溶液反应的化学方程式________________。
(2)①有机物B在浓硫酸存在条件下,相互作用生成一种环状酯(如下图)则有机物B的结构简式为_。
②等物质的量B与Na、NaOH、NaHCO3充分反应,消耗Na、NaOH、NaHCO3的物质的量之比为________。
(3) 1molA、C完全燃烧,消耗O2的质量相等,且1molC能和1molNa完全反应,写出含碳原子数最少的C的结构简式________,写出C与浓溴水的反应的化学方程式。
(4)D和B互为同分异构体,且知其苯环上连有三个取代基,苯环上的一氯代物只有两种,D不与NaHCO3溶液反应,能与Na和NaOH反应,等质量的D消耗Na和NaOH的物质的量之比为2∶3,则D的结构简式为、。(只写二种)
(每空2分,共8分)分子式为C3H6O3的物质有多种同分异构体,请写出符合下列要求的各种同分异构体的结构简式:(均用结构简式完成)
(1)A能与NaHCO3溶液反应,且1 molA与足量金属Na能生成1 molH2,则
A为或。
(2)B中所有同类原子的化学环境等同(如CH4中所有H所处化学环境等同),且不与Na反应,则B为。
(3)C中碳与氧分别有两种化学环境,氢的环境等同,且C与Na不反应,则C为。
(8分)X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。
已知:①X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物;②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。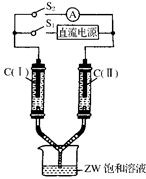
请回答:
(1)Z2Y的化学式是________________________。
(2)Z2Y2与X2Y反应的化学方程式是_______________________________________
(3)如图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
C(Ⅰ)的电极名称是________(填写“正极”或“负极”);
C(Ⅱ)的电极反应式是________________________________。
(4)铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是____________________________________。
根据下列五种元素的电离能数据(单位:kJ/mol),回答下面各题。
| 元素代号 |
I1 |
I2 |
I3 |
I4 |
| Q |
2080 |
4000 |
6100 |
9400 |
| R |
500 |
4600 |
6900 |
9500 |
| S |
740 |
1500 |
7700 |
10500 |
| T |
580 |
1800 |
2700 |
11600 |
| U |
420 |
3100 |
4400 |
5900 |
(1)在周期表中,最可能处于同一族的是()
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)电解它们的熔融氯化物,阴极放电反应最可能正确的是()
A.Q2++2e-→Q B.R2++2e-→R
C.S3++3e-→SD.T3++3e-→TE.U2++2e-→U
(3)它们的氯化物的化学式,最可能正确的是()
A.QCl2 B.RCl C.SCl3 D.TCl E.UCl4
(4)S元素最可能是()
A.S区元素 B.稀有气体元素 C.p区元素D.准金属E.d区元素
(5)下列元素中,化学性质和物理性质最像Q元素的是()
A.硼(1s22s22p1) B.铍(1s22s2) C.锂(1s22s1)D.氢(1s1) E.氦(1s2)
钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程的有关问题。
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
_________________________。
(2)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式______________________。
(3)下列哪些装置可防止铁棒被腐蚀_____________ 。
(4)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下:
请回答:
① A电极对应的金属是(写元素名称),B电极的电极反应式是。
②镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因:。