(10分) 向容积为2L的密闭容器中加入2 mol A、0.6 mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图1所示。图2为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。
已知t3-t4阶段为使用催化剂;图1中t0-t1阶段c(B)未画出。
(1) 若t1=15 min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)= 。
(2) t4-t5阶段改变的条件为 ,B的起始物质的量为 。各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 |
t2~t3 |
t3~t4 |
t4~t5 |
t5~t6 |
| K1 |
K2 |
K3 |
K4 |
K5 |
则K1、K2、K3、K4、K5之间的关系为 (用“>”“<”或“=”连接)。
(3) 在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,达到平衡时体系中各物质的量与t1时刻相等,a、b、c要满足的条件为 。
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1~18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物,其晶胞结构如图所示。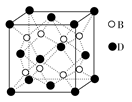
请回答:
(1)A元素的名称是。
(2)B的元素符号是,C的元素符号是,B与A形成的化合物比C与A形成的化合物沸点高,其原因是。
(3)E属元素周期表中第周期,第族的元素,其元素名称是,它的+2价离子的电子排布式为。
(4)从图中可以看出,D跟B形成的离子化合物的化学式为;该离子化合物晶体的密度为ag·cm-3,则晶胞的体积是(只要求列出算式)。
D、E、X、Y、Z是周期表中的前20号元素,且原子序数逐渐增大,它们的最简氢化物分子的空间构型依次是正四面体形、三角锥形、正四面体形、角形(V形)、直线形。回答下列问题:
(1)Y的最高价氧化物的化学式为。
(2)上述5种元素中,能形成酸性最强的含氧酸的元素是,写出该元素的任意3种含氧酸的化学式:、、。
(3)D和Y形成的化合物分子的空间构型为。
(4)D和X形成的化合物的化学键类型是,其晶体类型是。
(5)试比较D和X的最高价氧化物熔点的高低并说明理由:。
(1)可正确表示原子轨道的是。
| A.2s | B.2d | C.2px | D.3f |
(2)写出基态镓(Ga)原子的原子排布式:。
(3)下列物质变化,只与范德华力有关的是。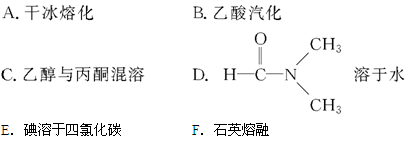
(4)下列物质中,只含有极性键的分子是,既含离子键又含共价键的化合物是;只存在σ键的分子是,同时存在σ键和π键的分子是。
AN2;BCO2;CCH2Cl2;DC2H4;EC2H6;FCaCl2;GNH4Cl
(5)用“>”、“<”或“=”填空:
第一电离能的大小:MgAl;熔点的高低:KClMgO。
有A、B、C、D四种短周期主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅有一种原子轨道,也是宇宙中最丰富的元素,B元素原子的核外p电子数比s电子数少1,C为金属元素且原子核外p电子数和s电子数相等;D元素的原子核外所有p轨道全满或半满。
(1)写出四种元素的元素符号:
A;B;C;D。
(2)写出C、D两种元素基态原子的轨道表示式:
C;
D。
(3)写出B、C两种元素单质在一定条件下反应的化学方程式:
。
(4)写出B元素单质和氢化物的电子式,单质,氢化物。
已知X、Y、Z为同一短周期的三种元素,其原子的部分电离能(kJ·mol-1)如下表所示:
| X |
Y |
Z |
|
| I1 |
496 |
738 |
578 |
| I2 |
4562 |
1451 |
1817 |
| I3 |
6912 |
7733 |
2745 |
| I4 |
9543 |
10540 |
11575 |
(1)三种元素电负性大小关系为。
(2)写出Y原子的电子排布式,Y的第一电离能大于Z的第一电离能的原因。
(3)X晶体采用下列(填字母)堆积方式。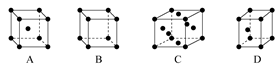
(4)含有元素X的盐的焰色反应为色。许多金属盐都可以发生焰色反应,其原因是。
(5)NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
| 晶体 |
NaCl |
KCl |
CaO |
| 晶格能/(kJ·mol-1) |
786 |
715 |
3401 |
4种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是。