如下图,通电5 min后,电极5质量增加2.16 g,回答:
(1)电源:a是________极,b是________极;A池电极反应,电极1:__________;
电极2:____________________________________________________________。
C池电极反应,电极5:________________________________________________;
电极6:______________________________________________________________。
(2)如果B池中共收集到224 mL气体(标准状况),且溶液体积为200 mL(设电解过程中溶液体积不变),则通电前溶液中Cu2+的物质的量浓度为________。
(1)若40g密度为ρ g·cm-3的Ca(NO3)2溶液中含有4 g Ca(NO3)2,则溶液中NO的物质的量浓度为 mol/L
(2)在标准状况下,将V L A气体(摩尔质量为M g·mol-1)溶于1 L水中,所得溶液的密度为ρ g·cm-3,则此溶液的物质的量浓度为 mol/L
(3)NA代表阿伏加德罗常数。已知C2H4和C3H6的混合物的质量为a g,则该混合物所含共用电子对数目为_____,所含碳氢键数目为_____。
(1)6.02×1023个氢氧根离子的物质的量是________mol,其摩尔质量为________。
(2)3.01×1023个H2O的物质的量为________mol,其中,所有的原子的物质的量为________mol,所有的电子的物质的量为________mol。
(3)1.204×1023个NH4+的物质的量为________mol,质量为________g。
为了除去氯化钠样品中的杂质碳酸钠,某兴趣小组最初设计了如下所示方案进行实验。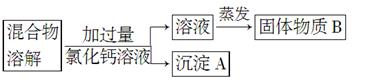
(1)沉淀A的化学式是________。
(2)加入过量氯化钙溶液后,分离除去沉淀A的实验操作过程是________________。
(3)他们在实验过程中,又发现了新的问题:此方案很容易引入新的杂质。固体物质B的成分为_____________(用化学式表示)。
(4)他们继续探究后又提出了新的方案:将混合物溶解,滴加盐酸至不再产生气泡为止,然后加热煮沸。有关反应的化学方程式为________________
标准状况下,H2和CO的混合气体共8.96 L,测得其质量为6.0 g,此混合气体中H2的质量为 ,CO体积为 。
在一密封容器中,1 mol CO和2 mol O2发生反应,生成1 mol CO2,求容器中C、O的原子个数比: 。