下表是元素周期表的一部分,表中字母分别代表某一化学元素,请回答有关问题。
(1)人们曾认为g、h、i不发生化学反应,因而把它们叫做稀有气体,但是后来发现这族气体可以参加化学反应,你认为g、h、i中最有可能首先被发现可以参加化学反应的元素是_______(写元素符号);g、h、i第一电离能由大到小的顺序为______。(用元素符号表示)
(2)e元素原子结构示意图为_____ __。d元素原子核外电子排布式为_____ __。
(3)a的阴离子半径__ __b的阳离子半径(填大于、等于、小于)。
(4)在元素周期表中有一个对角线规则,其中包括b、c的化合物的性质十分相似。则b的氯化物分别与少量和过量的氢氧化钠溶液发生反应的离子方程式分别为(要表达出具体的元素符号,下同)______ _______ __________;___________ ________________。
(5)f的+4价氧化物可与浓盐酸反应,且已知其氧化性强于氯气,则该氧化物与浓盐酸反应的化学方程式可表示为_____________ _________________________。
(6)元素周期表中第6周期中的镧系元素共有 种,它们原子的电子层结构和性质十分相似。
(7)元素k的氢化物乙可由两种10个电子的微粒组成的化合物甲(化学式X3Y2)与水剧烈反应能生成。甲与水反应的化学反应方程式为:____ ___。
反应m A+n B p C+q D在某温度下达到平衡。
p C+q D在某温度下达到平衡。
①若A、B、C、D都是气体,保持温度不变,将气体体积压缩到原来的一半,当再次达到平衡时C的物质的量浓度变为原来的1.8倍,则m、n、p ,q的关系是_____________。
②若A、B、C、D都为气体,且m+ n =" p+" q,则将气体体积压缩后A的物质的量将_________(填“减小”“增大”“不变”),平衡必定______移动。(填“正向”或“逆向”或“不”)
③若给体系升温, B的物质的量减少,则正反应为 ________反应(填“放热”“吸热”)
④若在体系中增加A的量,平衡不发生移动,则A肯定不能为_____态
⑤若加正催化剂,则反应物的转化率将________(填“减小”“增大”“不变”)
(每空2分,共12分)
(1)①相同温度下,相同物质的量浓度的Pb(NO3)2溶液的导电性远远大于(CH3COO)2Pb溶液的导电性,写出(CH3COO)2Pb的电离方程式:______________________________________________
②写出的CH3COONH4电离方程式
(2)取稀氨水进行下列操作,则NH3·H2O、NH4+、OH- H+ 浓度如何变化?
①通适量HCl气体时,c(NH3·H2O) ___________。(填写“增大”“减小”“不变”。下同)
②加入少量NaOH固体时,c(NH4+)___________。
③加入NH4Cl晶体时,c(OH-) _______。
④加入水时,c(H+) ____________
下图是中学化学的一个重要定量实验过程示意图,回答下列问题:
(1)该实验中的一处错误是。
(2)该实验中,能较精确确定液体体积的两种玻璃仪器是、。
(3)操作过程中多次用到玻璃棒,请分别说明它们在实验中的作用:操作②中、操作③中。
(4)不规范的实验操作会导致实验结果出现误差,分析下列操作对实验结果的影响(填“偏大”、“偏小”或“无影响”)。
a.在第②步操作中,有少量液体溅出烧杯外:。
b.在第③步操作中,容量瓶内本来有少量水:。
c.在第⑤步操作中,若俯视刻度线:。
d.在第⑥步操作中,经振荡、摇均、静置后发现液面低于刻度线,再加蒸馏水至刻度线:。
(5)若操作全部正确,最后所得的溶液应存放在试剂瓶中,并贴上标签,请填写标签上的内容(如图)。
现有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl—、Mg2+、Ba2+、CO32—、SO42—。现取3份100 mL该溶液分别进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH溶液加热后,收集到标准状况下20.16 L气体;
第三份加入足量BaCl2溶液后,经过滤、洗涤、干燥、得到白色沉淀,再将沉淀经足量盐酸洗涤,发现沉淀部分溶解。
根据上述实验,试回答下列问题:
(1)由第一份进行的实验对Cl-是否存在的判断是(填“一定存在”、“一定不存在”或“不能确定”);
(2)由第二份进行的实验得知该混合物中应含有(填离子符号),其物质的量浓度为;
(3)第三份实验中最终得到的沉淀成分为;(填化学式)
(4)综合上述实验,你认为以下结论正确的是。
| A.该混合液中一定含NH4+、CO32—、SO42—、K+,可能含Cl— |
| B.该混合液中一定含NH4+、CO32—、SO42—,可能含K+、Cl— |
| C.该混合液中一定含NH4+、CO32—、SO42—,可能含Mg2+、K+、Cl— |
| D.该混合液中一定含NH4+、SO42—,可能含Mg2+、K+、Cl— |
(15分)资源化利用CO2不仅可以减少温室气体的排放,还可以重新获得燃料或重要工业产品。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式为:6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H=-76.0kJ/mol,该反应中每生成1mol Fe3O4,转移电子的数目为。
(2)在一定条件下,二氧化碳转化为甲烷的反应为:CO2(g)+4H2(g)  CH4(g)+2H2O(g) △H<0
CH4(g)+2H2O(g) △H<0
①向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2mol/L, H2 0.8 mol/L, CH4 0.8 mol/L, H2O 1.6 mol/L。起始充入CO2和H2的物质的量分别为、。CO2的平衡转化率为。
②现有两个相同的恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ,在Ⅰ中充入1mol CO2和4molH2,在Ⅱ中充入1mol CH4和2molH2O(g),300℃开始反应,达到平衡时,下列说法正确的是()(填字母)。
| A.容器Ⅰ、Ⅱ中正反应速率相同 |
| B.容器Ⅰ、Ⅱ中反应的平衡常数相同 |
| C.容器Ⅰ中CO2的物质的量比容器Ⅱ中的多 |
| D.容器Ⅰ中CO2的转化率与容器Ⅱ中CH4的转化率之和小于1 |
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如下图所示: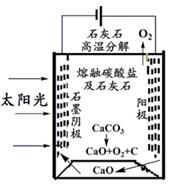
①上述生产过程的能量转化方式是、。
②上述电解反应在温度小于900℃时进行,碳酸钙分解为CaO和CO2,电解质为熔融碳酸钠,则阳极电极反应式为,阴极电极反应式为。