(1)利用反应6NO2+8NH3 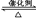 7N2+12 H2O可处理大气中的污染物NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O可处理大气中的污染物NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是 L。
已知:2SO2(g)+O2(g) 2SO3(g) ΔH="-196.6" kJ·mol-1
2SO3(g) ΔH="-196.6" kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH="-113.0" kJ·mol-1
2NO2(g) ΔH="-113.0" kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
(2)物质A~E都是中学化学中常见的物质,它们可发生如图所表示的反应:
在以上反应中(用序号填空):属于氧化还原反应的是 ;属于复分解反应的是 。反应③的离子方程式为 :
若以反应⑦设计一个原电池,则原电池的负极材料应为 。
(16分)氮化铝(AlN)陶瓷是一种类金刚石氮化物的新型无机非金属材料,最高可稳定到2200°C,导热性好,热膨胀系数小,是良好的耐热冲击材料。抗熔融金属侵蚀的能力强,是熔铸纯铁、铝或铝合金理想的坩埚材料。工业用氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。现要通过实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理
①已知Al4C3与硫酸反应可生成CH4,则该反应的离子方程式是______________。
②AlN溶于强酸生成铵盐,溶于氢氧化钠溶液生成氨气,请写出AlN与NaOH溶液反应的化学方程式___________。
(2)实验装置(如下图所示)
(3)实验过程
①连接实验装置,检验装置的气密性。称得D装置的质量为yg,滴定管的读数为amL。
②称取xgAlN样品置于锥形瓶中;塞好胶塞,关闭活塞K2、K3,打开活塞K1,通过分液漏斗加入过量____(填化学式),与锥形瓶内物质充分反应。
③待反应进行完全后,关闭活塞K1,打开活塞K3,通过分液漏斗加入过量 _______(填化学式),与锥形瓶内物质充分反应。
④打开K2,通过打气装置通入空气一段时间。
⑤记录滴定管的读数为bmL,称得D装置的质量为zg。
(4)数据处理与问答
①在上述装置中,设置活塞K2的目的是__________。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积_________(填“偏大”,“偏小”或“无影响”)。
③Al4C3的质量分数为 ____,AlN的质量分数为_______。
(14分)亚硫酸钠(Na2SO3)、漂白液(NaClO)和明矾[KAl(SO4)2∙12H2O]都是重要的化工产品,在日常生活和工业生产中都有广泛用途,且三者都可用在造纸业的不同生产工序中。
(1)NaClO做消毒液是它能与水反应产生一种强氧化性物质,写出该强氧化性物质的电子式_______。在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:____________。将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式 ____________。
(2)将饱和NaClO和KAl(SO4)2溶液混合,置于一只带单孔橡皮塞的大试管中,产生大量的白色胶状沉淀。此时反应的离子方程为____________。再将大试管置于阳光下照射,不久试管液面上方有浅黄绿色气体产生,将气体通入NaOH溶液充分吸收后,还能收集到一种无色无味的气体。写出在阳光照射下,混合液中反应的化学方程式____________。
若将KAl(SO4)2溶液换成硫酸亚铁铵【(NH4)2SO4∙FeSO4】溶液后,再与NaClO溶液混合,观察到大试管中有红褐色沉淀产生,同时溶液里现黄色,但没有气体生成。此时试管中发生反应的离子方程式为______。
(3)取一定体积KAl(SO4)2溶液于试管中,逐滴加入一定浓度的Ba(OH)2溶液, 直至产生沉淀的质量最大,写出此时的离子反应方程式____________。
(13分)下图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题
(1)表中某元素最高正价氧化物的水化物与其氢化物之间能相互反应生成离子化合物,则该离子化合物的名称是______,由元素④、⑥、⑦、⑧形成的简单离子的半径由大到小的顺序是_______(用离子符号表示,下同)。②、④、⑤元素的氢化物的沸点由高到低的顺序是____________。
(2)分别由上述两种元素组成、均为10e-的阴、阳离子,在加热条件下反应生成两种10e-的分子,写出该离子反应方程是________________。
(3)由表中四种元素形成X、Y、Z、M、N等常见物质,X、Y含有一种相同元素,其中X焰色反应呈黄色,可发生以下反应:
①X、Y与水混合后反应的离子方程式为________________。
②N→⑦的单质反应的化学方程式为_________________。
③若将Y溶液加热蒸干、灼烧后得到的物质的化学式是________________。
[化学—选修5:有机化学基础](15分)某有机化合物A的结构简式如图所示: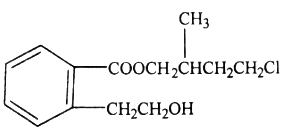
回答下列问题:
(1)A的分子式为__________________。
(2)A在NaOH水溶液中加热得到B和C,C是芳香族化合物,C则的结构简式是_____________。
(3)C酸化后可得F,F不能发生的反应类型是(填写字母代号)__________________。
a.取代反应
b.加成反应
c.消去反应
d.加聚反应
e.氧化反应
f.还原反应
(4)B与足量的某饱和一元羧酸D充分反应后生成E,E和B的相对分子质量之差为84,则D的摩尔质量为__________________。
(5)F可以发生如下转化,且G与H互为同分异构体。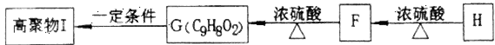
请写出:①H的结构简式__________________。 ②由F生成的G化学方程式________________。
(6)符合下列三个条件的F的同分异构体的数目有多种,任写出其中1种的结构简式____________。
①含有邻二取代苯环结构;
②F具有相同的官能团;
③不与FeCl3溶液发生显色反应。
[化学一选修3:物质结构与性质](15分)已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如图: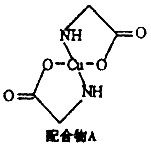
(1)Cu元素基态原子的电子排布式为 ________________。
(2)配合物A中碳原子的轨道杂化类型为________________, 配合物A中不存在( )
A.极性键
B.非极性键
C.氢键
D.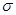 键
键
E.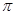 键
键
F.离子键
(3)lmol氨基乙酸钠(H2N-CH2-COONa)含有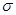 键的数目为_________。
键的数目为_________。
(4)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体且为负一价阴离子:________(写化学式)。
(5)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图,则该化合物的化学式是________,铜离子的配位数是________。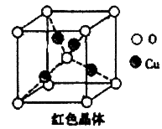
(6)配合物A中元素C、H、N、O组成的化合物CH4和NO,在400~500°C和Pt做催化剂下,能转化成无毒无害的物质,利用该反应可以控制机动车尾气排放。该反应方程式为:________________。