【化学—选修3物质结构与性质】前四周期原子序数依次增大的五种元素A、B、C、D中,A的族序数与最外层数、周期数相等, B元素是植物生长需要的营养元素,也是空气中含量最高的元素;C元素处于第二周期且价电子层中未成对电子数为2,D元素周期表中ds区元素且最外电子层上只排布了一个电子。
回答下列问题:
(1)A、B、C三种元素中第一电离能由小到大的顺序是 ,(填元素符号)
(2)A、B两种元素形成的化合物B2A4是一种高能燃料,在工业生产中用途广泛。写出其电子式 ,该化合物的类型是_______(填离子化合物、共价化合物)。
(3)发射火箭时,常以B2A4为燃料,用双氧水作氧化剂,两者反应生成无毒、无害的气体。已知3.2g液态N2H4在上述反应中放出128.44kJ的热量,则该反应的热化学方程式:_______。
(4)①D2+的价层电子排布图为 。
②胆矾CuSO4·5H2O可写成[Cu(H2O) 4]SO4·H2O,其结构示意图如下:
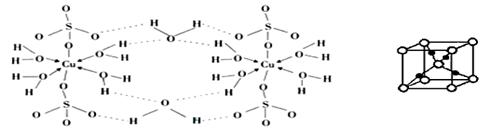
在胆矾中含有的粒子间作用力是 (填序号)。
a.离子键
b.极性键
c.金属键
d.配位键
e.氢键
f.非极性键
③在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,指出1molCN-中p键的数目为 。胆矾受热分解得到铜的某种氧化物,其晶胞结构如上图所示,则氧的配位数是 。
在容积不变的密闭容器中,分别充入1.0 mol N2和3.0 mol H2,在不同温度下,任其发生反应:N2(g)+3H2(g) 2NH3(g)。分别在同一时刻,不同温度下测定NH3的含量,然后绘制出如下图所示的曲线。
2NH3(g)。分别在同一时刻,不同温度下测定NH3的含量,然后绘制出如下图所示的曲线。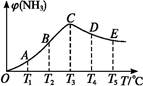
请回答下列问题:
(1)A、B、C、D、E五点中,尚未达到平衡状态的是 。
(2)此可逆反应的正反应是 (填“放热”或“吸热”)反应。
(3)AC段的曲线是增函数,CE段的曲线是减函数,试从反应速率和化学平衡的角度说明理由: 。
近年来,随着人们对化石能源大量的开发使用,不但使得煤、石油、天然气的储量大大减少,而且直接燃烧化石燃料造成的环境污染问题,也是人类面临的重大挑战,如何实现化石燃料的综合利用,提高效率,减少污染被提上了日程。为了提高煤的利用率,人们先把煤转化为CO和H2,再将它们转化为甲醇。某实验人员在一定温度下的密闭容器中,充入一定量的H2和CO,发生反应:
2H2(g)+CO(g)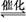 CH3OH(g),测定的部分实验数据如下:
CH3OH(g),测定的部分实验数据如下:
| t/s |
0 |
500 |
1 000 |
| c(H2)/(mol·L-1) |
5.00 |
3.52 |
2.48 |
| c(CO)/(mol·L-1) |
2.50 |
(1)在500 s内用H2表示的化学反应速率是 。
(2)在1 000 s内用CO表示的化学反应速率是 ,1 000 s时CO的转化率是 。
(3)在500 s时生成的甲醇的浓度是 。
在2 L密闭容器中进行反应:mX(g)+nY(g) pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
| 物质 时间 |
X |
Y |
Z |
Q |
| 起始/mol |
0.7 |
1 |
||
| 2 min末/mol |
0.8 |
2.7 |
0.8 |
2.7 |
| 3 min末/mol |
0.8 |
已知2 min内v(Q)=0.075 mol·L-1·min-1,,
(1)试确定以下物质的相关量:
起始时n(Y)= ,n(Q)= 。
(2)方程式中m= ,n= ,p= ,q= 。
(3)用Z表示2 min内的反应速率 。
某温度时,在2 L容器中,某一反应中A、B的物质的量随时间变化的曲线如下图所示,由图中数据分析得: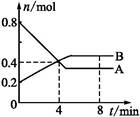
(1)在4 min末时,A、B的物质的量浓度c(A) c(B);从0~4 min内A、B的物质的量浓度变化量Δc(A) Δc(B)(以上填“>”“<”或“=”)。
(2)从反应开始至4 min时,A的平均反应速率为 。
(3)该反应的化学方程式为 。
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 mol液态肼与足量液态双氧水反应,生成水蒸气和氮气,放出256.652 kJ的热量。
(1)反应的热化学方程式为 。
(2)已知H2O(l) H2O(g) ΔH="+44" kJ·mol-1则16 g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
H2O(g) ΔH="+44" kJ·mol-1则16 g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
(4)发射卫星可用肼为燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。已知:
N2(g)+2O2(g) 2NO2(g) ΔH=+67.7 kJ·mol-1
2NO2(g) ΔH=+67.7 kJ·mol-1
N2H4(g)+O2(g) N2(g)+2H2O(g) ΔH="-534" kJ·mol-1
N2(g)+2H2O(g) ΔH="-534" kJ·mol-1
肼和二氧化氮反应的热化学方程式为 。