某河道两旁有甲、乙两厂。它们排放的工业废水中,共含 K+、Ag+、Cu2+、OH-、Cl-和NO3-六种离子。
(1)甲厂的废水明显呈碱性,故甲厂废水中含有的三种离子分别是 、 、 (填离子符号);
(2)乙厂的废水中含有另外三种离子。如果加一定量 (选填:活性炭、硫酸亚铁、铁粉),可以回收其中的金属 、 、(填写金属元素符号)。
(3)另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的 、 、 、 (填写离子符号)转化为沉淀。经过滤后的废水主要含 (填写化学式),可用作肥料来浇灌农田。
物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子浓度由大到小的顺序为。
(2)B为0.1 mol·L-1 NaHCO3溶液,实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因:。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入,目的是;
若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为。
(1)某温度时,水的离子积KW=1×10-13,则该温度25℃(填“>”、“<”或“=”)。在此温度下,某溶液中由水电离出来的H+浓度为1×10-10 mol/L,则该溶液的pH可能为。
(2)若温度为25℃时,体积为Va、pH=a的H2SO4与体积为Vb、pH=b的NaOH混合,恰好中和。此溶液中各种离子的浓度由大到小的排列顺序是:。
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引用了各界的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g),该反应的能量变化如图所示:
CH3OH(g)+H2O(g),该反应的能量变化如图所示: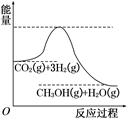
(1)上述反应平衡常数K的表达式为,温度降低,平衡常数K(填“增大”、“不变”或“减小”)。
(2)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5 min末,用氢气浓度变化表示的平均反应速率v(H2)=。
| t/min |
0 |
2 |
5 |
10 |
15 |
| n(CO2)/mol |
1 |
0.75 |
0.5 |
0.25 |
0.25 |
(3)下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是(填写序号字母)
a.及时分离出CH3OH气体
b.适当升高温度
c.保持容器的容积不变,再充入1 mol CO2和3 mol H2
d.选择高效催化剂
(1)在容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);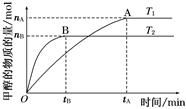
下列说法正确的是(填序号);
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=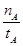 mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时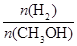 增大
增大
(2)在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为α,则容器内的压强与起始压强之比为。
在一个2 L的密闭容器中,加入3 mol A和1 mol B,发生下述反应:
3A(g)+B(g)2C(g)+3D(s),5 min达到平衡时,C的浓度为0.6 mol/L。
(1)达到平衡时,A的转化率为,此温度下的平衡常数K=。
(2)维持容器的温度不变,若缩小容器的体积,则平衡将向(填“正反应方向移动”“逆反应方向移动”或“不移动”)。
(3)维持容器的体积和温度不变,向密闭容器中加入氦气,达到新平衡时,B、C的浓度之比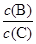 将(填“增大”、“减小”或“不变”)。
将(填“增大”、“减小”或“不变”)。
(4)当增加A的浓度,B的转化率;若将C分离出来,化学平衡常数。(填“增大”、“减小”或“不变”)