根据你学习的有关氨的知识,完成下面的问题。
(1)合成氨对化学工业具有重要意义。写出氨的两种重要用途_________;__________。
(2)实验室制备氨气,下列方法中最适宜选用的是______________。
①固态氯化氨加热分解
②固体氢氧化钠中滴加浓氨水
③氯化氨溶液与氢氧化钠溶液共热
④固态氯化氨与氢氧化钙混和加热
硫酸锌是制备荧光粉的原料之一。工业上由锌白矿(主要成分是ZnO,还含有Fe2O3、CuO、SiO2等杂质)制备ZnSO4•7H2O的流程如下。
已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7,6.5,9.7。
(1)浸取过程中提高浸出效率可采用的措施有 (任答一条),
ZnO和硫酸反应的化学方程式为 。
(2)加入适量锌粉的作用为:①使溶液中的Fe3+转化为Fe2+;② 。
(3)氧化过程中H2O2发生反应的离子方程式为 。
(4)加入适量Ca(OH)2调节溶液pH,促进Fe3+水解,Fe3+水解反应的平衡常数表达式
K= ,Ca(OH)2不能过量的原因是 。
(1)下列关于工业生产说法正确的是。(填序号)
| A.在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气 |
| B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率 |
| C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室 |
| D.工业上采用电解熔融氯化铝的方法制取金属铝 |
E.石油裂化属于化学变化,主要目的是为了获得短链不饱和气态烃
(2)我国规定饮用水质量标准必须符合下表中要求:
| pH |
Ca2+、Mg2+总浓度 |
细菌总数 |
| 6.5~8.5 |
< 0.0045 mol·L-1 |
<100个·mL-1 |
以下是原水处理成自来水的工艺流程示意图: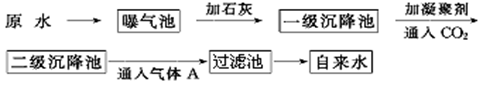
①原水中含Ca2+、Mg2+、HCO3-、Cl-等,加入石灰生成Ca(OH)2,进而发生若干复分解反应,写出其中的离子方程式(只要求写出两个):________________;__________________。
②FeSO4·7H2O是常用的凝聚剂,它在水中最终生成_________沉淀;通入二氧化碳的目的是_______________和_______________。
③气体A的作用是________,通常可以用Ca(ClO)2替代A,下列物质中同样可以作为气体A的代用品的是_______(填编号)。
a.ClO2 b.浓氨水 c.K2FeO4 d.SO2
Ⅰ.电离平衡常数(用K表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
| 化学式 |
HF |
H2CO3 |
HClO |
| 电离平衡常数 (K) |
7.2×10-4 |
K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
(1)物质的量浓度均为0.1mol/L的下列四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③NaF溶液 ④NaClO溶液。依据数据判断pH由大到小的顺序是______________。
(2)25℃时,在20mL0.1mol·L—1氢氟酸中加入VmL0.1mol·L—1NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_______。
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(F-)<c(Na+)=0.1mol·L—1
(3)已知25℃时,①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH=-akJ·mol—1,
②H+(aq)+OH-(aq)=H2O(l) ΔH=-bkJ·mol—1,
氢氟酸的电离方程式及热效应可表示为________________________。
(4)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H—O—F。HFO与等物质的量的H2O反应得到HF和化合物A,则每生成1molHF转移_______mol电子。
Ⅱ.氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点–54.1℃,沸点69.1℃。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
SO2(g)+Cl2(g)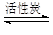 SO2Cl2(l) △H=–97.3kJ·mol—1
SO2Cl2(l) △H=–97.3kJ·mol—1
(1)试写出常温常压下化学平衡常数K的表达式:K=_________________;
(2)对上述反应,若要使化学平衡常数K增大,化学反应速率v正也增大,可采取的措施是_____(选填编号)。
a.降低温度b.移走SO2Cl2
c.增加反应物浓度d.无法满足上述条件
(3)下列描述中能说明上述反应已达平衡的是____________(选填编号)。
a.υ(Cl 2)=υ(SO2) b.容器中气体压强不随时间而变化
c.c(Cl 2) : c(SO2)=1:1 d.容器中气体颜色不随时间两变化
(4)300℃时,体积为1L的密闭容器中充入16.20g SO2Cl2,达到平衡时容器中含SO2 7.616g。若在上述中的平衡体系中,再加入16.20g SO2Cl2,当再次达平衡时,容器中含SO2的质量范围是________________________。
某消毒液的主要成分为NaCl和NaClO,在空气中易吸收CO2而变质,且NaCl和NaClO在酸性条件下可发生反应:ClO-+ Cl-+ 2H+ = Cl2↑+ H2O。某学习小组拟探究该消毒液的变质情况。
(1)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。通过下列装置检验气体的成分可以判断消毒液是否变质。
学习小组研究后认为变质情况可能有三种:甲:部分变质;乙:未变质;丙:。
为了验证可能为甲,请完成下列实验方案。限选试剂:
①98%的浓硫酸②1%的品红溶液③1.0 mol·L-1的KI-淀粉溶液④1.0 mol·L-1 的NaOH溶液⑤澄清石灰水⑥饱和NaCl溶液
| 所加试剂 |
预期现象和结论 |
| 试管A中加足量(填序号); 试管B中加1%品红溶液; 试管C中加(填序号)。 |
若___ ___, 则甲成立。 |
(2)用滴定法测定消毒液中NaClO的浓度(滴定过程涉及的反应有:NaClO + Na2SO3 = NaCl+ Na2SO4 ;2KMnO4 + 5Na2SO3+ 3H2SO4 = K2SO4 + 2MnSO4 + 5Na2SO4 + 3H2O)。实验步骤如下:
①量取25.00 mL消毒液放入锥形瓶中,加入过量的a mol·L-1 Na2SO3溶液v1 mL;
②在使用滴定管之前首先进行的操作是____;将b mol·L-1的酸性KMnO4溶液装入中;滴定,KMnO4和剩余的Na2SO3发生反应。当溶液由无色变成浅红色,且保持半分钟内红色不褪时,停止滴定,记录数据。
③重复滴定操作2次,平均消耗酸性KMnO4溶液v2 mL。则消毒液中NaClO的浓度为mol·L-1(用含a、b、v1、v2的代数式表示)。
(l)铝与某些金属氧化物在高温下的反应称为铝热反应,可用于冶炼高熔点金属。
已知:4Al(s)+3O2(g)=2Al2O3(s) 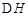 =-2830kJ·mol-1
=-2830kJ·mol-1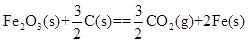
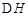 =+230kJ·mol-1
=+230kJ·mol-1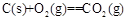
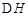 =-390kJ·mol-1
=-390kJ·mol-1
铝与氧化铁发生铝热反应的热化学方程式是。
(2)如下图所示,各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是;
②装置中Cu电极上的电极反应式为。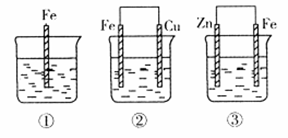
(3)钒(V)及其化合物广泛应用于新能源领域。全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示。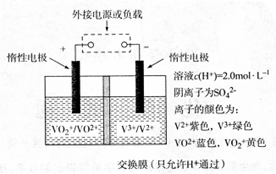
①当左槽溶液逐渐由黄变蓝,其电极反应式为。
②充电过程中,右槽溶液颜色逐渐由色变为色。