下表列出了前20号元素中的某些元素性质的有关数据:
| 元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
| 原子半径(10-10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
| 最高价态 |
+1 |
+1 |
/ |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
/ |
| 最低价态 |
/ |
/ |
-2 |
/ |
-4 |
-3 |
-1 |
/ |
-3 |
-1 |
试回答下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是 (填编号)。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式) 。
(3)某元素R的原子半径为1.02×10-10m,该元素最高价氧化物的水化物化学式为 ;若物质Na2R3是一种含有非极性共价键的离子化合物,请你尝试写出该化合物的电子式 。
粗氧化锌中含少量CuO、Fe3O4、SiO2等杂质。工业上以粗氧化锌生产硫酸锌晶体(ZnSO4·7H2O)的工艺流程如下图所示:
已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7,6.5,9.7。
请回答下列问题:
(1)操作③的名称是;
(2)加入适量锌粉的作用为;
(3)加入30%H2O2反应的离子方程式是;
(4)加入适量Ca(OH)2调节溶液pH,促进Fe3+水解,Fe3+水解反应的平衡常数表达式K= ,Ca(OH)2不能过量的原因是 。
一定温度时,在容积一定的密闭容器中,反应A(?)+B(g)  C(g)+D(g)达到平衡后,升高温度容器内气体的密度增大。请回答下列问题:
C(g)+D(g)达到平衡后,升高温度容器内气体的密度增大。请回答下列问题:
(1)正反应是(填“放热”或“吸热”)反应;该反应的化学平衡常数的表达式是。
(2)能判断该反应一定达到平衡状态的依据是。(填写字母编号)
A.体积分数组成C%=D%
B.单位时间内生成n molA的同时生成n molC
C.温度和体积一定时,某一生成物浓度不再变化
D.温度和体积一定时,容器内压强不再变化
(3)该反应的正反应速率随时间变化的关系如图所示。t2时改了某种条件,改变的条件是。(填写字母编号)
A.升温 B.加压 C.催化剂 D.增加A的量
(4)升高温度到T℃时,在一密闭容器中充入2mol A和3mol B,发生上述反应。平衡后测得K=1。然后在温度不变的情况下,扩大容器容积至原来的10倍,结果A的百分含量始终未改变,则此时B的转化率是。
氮是地球上含量丰富的原子元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)25℃时,0.1mol/LNH4NO3溶液中水的电离程度(填“大于”、“等于”或“小于”) 0.1mol/L NaOH溶液中水的电离程度。
(2)若将0.1mol/L NaOH溶液和0.2mol/LNH4NO3溶液等体积混合,混合溶液中2c(NH4+)>c(NO3-),所得溶液中离子浓度由大到小的顺序是。
(3)发射火箭时肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。经测定16g气体在上述反应中放出284kJ的热量。则该反应的热化学方程式是。
(4)下图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图。
已知:N2(g)+O2(g)=2NO(g)△H=+180kJ/mol
2NO (g)+O2(g)=2NO2(g)△H=-112.3kJ/mol
则反应:2NO(g)+2CO(g) N2(g)+2CO2(g)的△H是。
N2(g)+2CO2(g)的△H是。
生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与混合,在含有Zn、Cu等元素的催化剂条件下能合成一种生物质能——甲醇。
(1) 与CO互为等电子体的物质的化学式是。
(2) CO2分子中碳原子的杂化类型是杂化。
(3) 按电子排布Zn在元素周期表中属于区,
其晶体属于六方最密堆积,它的配位数是。
(4) Cu的一种氯化物晶体的晶胞结构如图所示。(空心球代表氯离子),则一个晶胞中所含的数目是。
工业上用粉碎的煤矸石(主要含Al2O3、SiO2及铁的氧化物)制备净水剂BAC〔Al2(OH)nCl6-n〕的流程如下: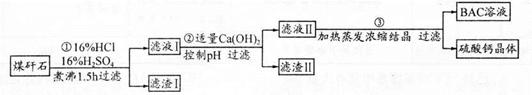
(1)粉碎煤矸石的目的是______;滤渣I的主要成分是______ (填化学式)。
(2)步骤①在煮沸的过程中,溶液逐渐由无色变为绿色,此时溶液中有色离子为______(填化学式);随后溶液又变为棕黄色,相关离子反应方程式为______;
步骤①的煮沸装置上方需安装一长导管,长导管的作用是____________。
(3)步骤②中加入适量的Ca(OH)2并控制pH,其目的:一是生成BAC;二是___________;巳知BAC的分散质粒子大小在1 nm〜100 nm之间,由此区别滤液I与BAC两种液体的物理方法是______;若Ca(OH)2溶液过量,则步骤③得到的BAC产率偏低,写出该反应的离子方程式______。
(4)若0.1 molAlCl3在某温度下溶于蒸馏水,当有5℅水解生成Al(OH)3溶液时,吸收热量a kJ。写出该过程的热化学方程式____________。