一同学用某种粗盐进行提纯实验,步骤见下图。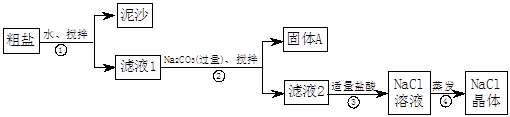
请回答:
(1)步骤①和②的操作名称是 。
(2)步骤③判断加入盐酸“适量”的方法是 ;步骤④加热蒸发时要用玻棒不断搅拌,这是为了防止 ,当蒸发皿中有较多量固体出现时,应 ,用余热使水份蒸干。
(3)猜想和验证:
| 猜 想 |
验证的方法 |
现象 |
结论 |
| 猜想Ⅰ:固体A中含CaCO3、MgCO3 |
取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 |
|
猜想Ⅰ成立 |
| 猜想Ⅱ:固体A中含BaCO3 |
取少量固体A于试管中,先滴入 ,再滴入Na2SO4溶液 |
有气泡放出,无白色沉淀 |
|
| 猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 |
取少量NaCl晶体溶于试管中的蒸馏水, |
|
猜想Ⅲ成立 |
某化学兴趣小组的同学围绕“澄清石灰水与碳酸钠溶液的反应”展开了如下探究活动。
(1)该反应的化学方程式为_____________________________________.
(2)反应后溶液中的溶质是什么?同学们一致认为有以下三种情况:①氢氧化钠和氢氧化钙;②氢氧化钠和碳酸钠;③________________.
(3)小新取少量溶液于试管中,滴加过量稀盐酸,发现无气泡产生,说明情况________(填序号)是不可能的。
为了进一步确定溶液的成分,同学们设计了如下实验方案:
小红选择了另外一种不同类别的物质_________(填化学式),也得到了同样的结论。
在做盐和盐反应的分组实验时,第一组学生进行氯化钡与碳酸钠溶液的反应,第二组学生进行氯化钡和硫酸钠溶液的反应。
实验结束后,两组同学将全部的浊液集中倒进一个废液缸中,浊液中白色沉淀物质是______和______.
化学兴趣小组对浊液进行过滤,探究滤液的成分。
【提出问题】滤液里除了氯化钠外,还有什么物质?
【提出猜想】猜想①:__________;猜想②: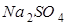 ;猜想③:
;猜想③: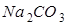 ;猜想④:
;猜想④: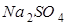 、
、
【实验探究】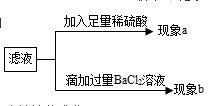
若现象a只有白色沉淀,则猜想________成立;
若现象a只有气泡产生,则猜想________可能成立;
若现象b产生白色沉淀,然后加稀硝酸沉淀部分溶解,并产生气泡,则猜想_______成立;若沉淀全部不溶解,则猜想________成立。
从海水中得到的粗盐,往往含有可溶性杂质(主要有Na2SO4、MgCl2、CaCl2)和不溶性杂质(泥沙等),必须进行分离和提纯后才能用于工业生产和人们的日常生活.粗盐提纯的部分流程如下:
其中,滤液一→滤液二之间需进行三步操作:
操作①:加入过量Na2CO3,除去滤液中的Ca2+
操作②:加入过量X,除去滤液中的Mg2+
操作③:加入过量BaCl2,除去滤液中的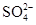
请回答:
(1)操作②中的物质X为________________,正确的操作顺序为________(填序号),为最终获得精盐,操作①、②和③后还需增加的操作是________________;
(2)滤液二中加入适量稀盐酸的目的是________________________.
氯化钠是生活必需品,也是重要的化工原料.提纯含少量泥沙的粗盐,一般经过以下操作流程:
(1)操作①中必须用到的一种仪器是________(填序号).
(A)研钵
(B)量筒
(C)烧杯
(D)试管
(2)操作④中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是________(填序号).
(3)操作⑤中除用到三脚架、酒精灯、玻璃棒、坩埚钳外,还需要用到________等仪器.该操作中容易造成食盐固体飞溅,为尽量减少飞溅,除连续搅拌外还可采取________等措施.
(4)实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低,其可能原因是________(填序号).
(A)食盐没有全部溶解即过滤
(B)蒸发时食盐飞溅剧烈
(C)蒸发后,所得精盐很潮湿
(D)器皿上沾有的精盐没全部转移到称量纸上
圆梦中学化学兴趣小组根据所学的酸碱指示剂的知识,准备自制酸碱指示剂:她们分别用蓝紫色牵牛花、大红色、月季花、紫萝卜花、丝瓜花提取指示剂。
步骤1:分别在研钵中将上述物质倒烂,加乙醇溶液(乙醇和水的体积比为1:1)浸泡10分钟。
(1)用研钵捣烂的目的是_________;(2)乙醇在其中起到的作用是_________。
| A.催化剂 | B.参加化学反应 | C.溶质 | D.溶剂 |
步骤2:将步骤1得到的混合物,用纱布过滤;(3)过滤的目的是_________。
步骤3:将步骤2中得到的浸取液,分别滴入到澄清石灰水中。
(4) 上述四种浸取液,最不适合用作酸碱指示剂的_______(填名称) 。
(5) 将月季花的浸取液滴入稀盐酸中,溶液呈_______色;低入氢氧化钠溶液中,溶液呈_______色。