为除去粗盐中的Ca2+、Mg2+、SO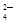 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):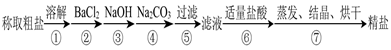
(1)在第①步和第⑤步中都需要用到玻璃棒,其作用分别是_____________、______________。
(2)判断BaCl2已过量的方法是_____________________________________________________。
(3)第④步中,相关的离子方程式是________________________________________________。
(4)若先用盐酸再过滤,将对实验结果产生影响,其原因是____________________________。
某铜矿石中铜元素含量较低,且含有铁、镁、钙等杂质离子。某小组在实验室中用浸出-萃取法制备硫酸铜:
(1)操作I为_______。操作II用到的玻璃仪器有烧杯_______
(2)操作II、操作III的主要目的是_______、富集铜元素。
(3)小组成员利用CuSO4溶液与Na2CO3溶液混合反应,制备环保型木材防腐剂Cu2(OH)2CO3悬浊液。多次实验发现所得蓝色悬浊液颜色略有差异,查阅资料表明,可能由于条件控制不同使其中混有较多Cu(OH)2或Cu4(OH)6SO4。
已知Cu(OH)2、Cu2(OH)2CO3、Cu4((OH)6SO4均难溶于水,可溶于酸;分解温度依次为 80℃、200℃、300℃。
设计实验检验悬浊液成分,完成表中内容。
限选试剂:2mol•L-1HCl、1 mol•L-1H2SO4、0.1 mol•L-1NaOH、0.1 mol•L-1 BaCl2、蒸馏水。仪器和用品自选。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少量悬浊液,过滤,充分洗涤后,取滤渣于试管中,_______________________________________________________________ |
说明悬浊液中混__________________________________________,有Cu4( OH)6SO4。 |
| 步骤2:另取少量悬浊液于试管中,____________________________ |
______________, 说明悬浊液中混有Cu( OH) 2。 |
(4)上述实验需要100mL 0.5 mol•L-1的CuSO4溶液,配制时需称取_______gCuSO4•5H2O (化学式量:250)。
亚铁盐中,FeSO4•7H2O露置于空气中易被氧气氧化,而莫尔盐[(NH4)2SO4•FeSO4•6H2O]露置于空气中不易被氧气氧化,是一种重要的定量分析试剂。其制备原理是:FeSO4+(NH4)2SO4+6H2O =(NH4)2SO4•FeSO4•6H2O。
实验室用废铁屑制备莫尔盐的过程如下: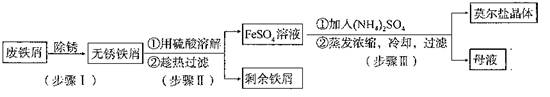
(1)步骤I除锈的操作是:将废铁屑放入烧杯,,过滤,洗涤。
(2)步骤II铁屑的溶解在锥形瓶中进行,并水浴加热到60℃左右,需要的仪器是铁架台、石棉网、大烧杯、。
(3)步骤III中加入的(NH4)2SO4与溶液中FeSO4的物质的量需满足的关系为:n[(NH4)2SO4]∶n[FeSO4]=。
为了确定(NH4)2SO4的用量,下列方法简便可行的是(填编号)。
A.称量废铁屑的质量,推算所需(NH4)2SO4的质量
B.称量无锈铁屑和步骤II之后剩余铁屑的质量,推算所需(NH4)2SO4的质量
C.测定FeSO4溶液的浓度和体积,推算所需(NH4)2SO4的质量
(4)所得晶体样品中可能混有的杂质是FeSO4·7H2O和(NH4)2SO4中的一种。某小组设计了如下方案进行检验和测定,请在答题卡上完成表中内容。
| 序号 |
实验方案 |
实验现象和结论 |
| 步骤1 |
取少量样品 |
样品颜色可能有变化。 |
| 步骤2 |
步骤1后将样品转移到试管中,加入去氧蒸馏水,振荡溶解,调节至酸性,________ ___________ __ 。 |
若,说明样品中含有FeSO4·7H2O杂质。 |
| 步骤3 |
若步骤2证明样品不含FeSO4•7H2O杂质,再另取样品测定其中NH4+的质量分数w1与理论值w2比较。 |
若w1w2,说明样品中含有(NH4)2SO4杂质。 |
(已知(NH4)2SO4•FeSO4•6H2O的式量为392,(NH4)2SO4的式量为132)
某工厂废液中含有苯酚、乙酸,实验小组对该废液进行探究,设计如下方案:
己知熔点:乙酸16.6℃、苯酚43℃。沸点:乙酸118℃、苯酚182℃。
(1)写出②的反应化学方程式。
(2)②中分离B的操作名称是。
(3)现对物质C的性质进行实验探究,请你帮助实验小组按要求完成实验过程记录,在答题卡上填写出实验操作、预期现象和现象解释。
限选试剂:蒸馏水、稀HNO3、2moL·L—1NaOH、0.1 mol •L—1KSCN、酸性KMnO4溶液、FeCl3溶液、饱和溴水、紫色石蕊试液。
| 实验操作 |
预期现象 |
现象解释 |
| 步骤1:取少量C放入a试管,加入少量蒸馏水,振荡。 |
||
| 步骤2:取少量C的稀溶液分装b、c两支试管,往b试管 |
产生白色沉淀 |
|
| 步骤3:往c试管 |
C与加入的试剂发生显色反应。 |
(4)称取一定量的C试样,用水溶解后全部转移至1000mL容量瓶中定容。取此溶液 25.00mL,加入浓度为0.0500 moL·L-1的溴水溶液30.00mL,放置。待反应完全后,加入过量的KI,再用0.1100 moL•L-1Na2S2O3标准溶液滴定生成的I2,耗去Na2S2O3标准溶液11.80mL。则试样中C物质的量的计算表达式为:。(部分反应离子方程式:I2+2S2O32—=2I—+S4O62—)
发酵粉是一种生产面制品和膨化食品的化学膨松剂,由小苏打、臭粉(碳酸氢铵)、明矾中的两种物质组成。某研究性学习小组为探究不同品牌的发酵粉的化学成分,进行如下实验。
【提出假设】
(1)假设1:由小苏打和臭粉组成;
假设2:由小苏打和明矾组成;
假设3:由________________组成。
【方案与流程】
为探究某品牌的发酵粉的化学成分,某同学设计如下实验,得到如下现象: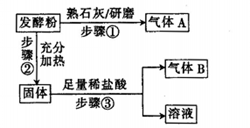
(2)该发酵粉的成分为________ (填化学式)。
(3)另一品牌的发酵粉的化学组成可能为假设2情况,请你设计实验验证,写出实验步骤、预期现象和结论。
| 实验步骤 |
 预期现象结论 预期现象结论 |
| 1.取少量样品溶于稀盐酸后,将溶液分成两份 |
|
| 2. _______________________________________ |
|
| 3. ________________________________________ |
(4)另一品牌的发酵粉的化学组成为小苏打和碳酸氢铵,为探究其化学式[化学式可表示为nNaHCO3·m NH4HCO3],称取4.05 g该产品在烧杯中溶解后,移入________配成100 mL溶液,用移液管取25.00mL溶液,滴加足量盐酸,生成的气体通入过量澄清石灰水中,生成的白色沉淀经干燥,称量为1.25 g。则该发酵粉的化学式为。
(相对分子质量:NaHCO3:84 NH4HCO3:79 CaCO3:100)
铝广泛应用于化学工业和日常生活中。工业上由铝土矿(Al2O3∙3H2O的含量约为85%,其余主要为SiO2、Fe2O3等)冶炼金属铝的流程如下。
已知拜耳法生产Al2O3∙3H2O的基本原理为:
Al2O3∙3H2O+2NaOH(aq) 2NaAlO2(aq)+4H2O,[Al2O3∙3H2O也可表示为2 Al(OH)3]
2NaAlO2(aq)+4H2O,[Al2O3∙3H2O也可表示为2 Al(OH)3]
(1)操作I的名称为,赤泥中除含有铝硅酸盐外,还含有的主要物质有。
(2)为了提高铝土矿的溶出速率可采取的有效措施为
(任写三点)。
(3)用化学平衡理论解释稀释溶液I有利于Al2O3∙3H2O 结晶的原因____________。
(4)为了析出Al2O3∙3H2O,也可向溶液I中通入过量CO2气体,写出生成Al2O3∙3H2O的离子方程式:。
(5)为了回收赤泥附着液带走的有用成分,工业上将用热水洗涤后的洗液用作溶液I的稀释剂,请指出流程图中另一处类似的做法。