全球海水中溴的藏量丰富,约占地球溴总藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg/L。其工业提取方法有:
(1)空气吹出纯碱吸收法。方法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到溴单质。该方法涉及到的反应有:① (写出化学方程式);②3Br2+3CO32—=BrO3—+ 5Br—+3CO2↑;③BrO3—+ 5Br—+6H+=3Br2+3H2O。
其中反应②中氧化剂是 ;还原剂是 。
(2)空气吹出SO2吸收法。该方法基本同(1),只是将溴吹出后是用SO2来吸收的,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴。写出溴与二氧化硫的反应化学方程式:_ __________________________________________。
(3)溶剂萃取法。该法是利用单质溴在水中和溶剂中溶解度的不同的原理来进行的。实验室中萃取用到的实验仪器名称是 。下列可以用于海水中溴的萃取试剂的 。
①乙醇 ②四氯化碳 ③硝酸
(7分)乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。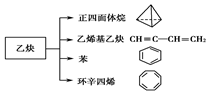
完成下列各题:
(1)正四面体烷的分子式为________,其二氯取代产物有________种。
(2)关于乙烯基乙炔分子的说法错误的是________。
a.能使酸性KMnO4溶液褪色 b.1mol乙烯基乙炔能与3molBr2发生加成反应
c.乙烯基乙炔分子内含有两种官能团
d.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式。
(4)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例)________、________。
(1) 系统命名法命名: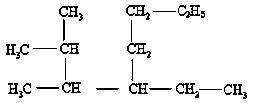
(2)由甲苯为原料,制取烈性炸药(TNT)的化学方程式:
铝铵矾[NH4Al(SO4)2·12H2O]是一种重要的工业原料,将它溶于水配成溶液,然后逐滴滴入NaOH(aq),已知:NH +AlO
+AlO +H2O====Al(OH)3↓+NH3↑,写出先后发生反应的离子方程式:
+H2O====Al(OH)3↓+NH3↑,写出先后发生反应的离子方程式:
(1),
(2),
(3)NH3·H2O NH3↑+H2O,
NH3↑+H2O,
(4)。
现有五种离子化合物A、B、C、D和E,都是由下表中离子形成的:
| 阳离子 |
Ag+ Ba2+Al3+ |
| 阴离子 |
OH- Cl- SO42- |
为鉴别它们,分别完成以下实验,其结果是:
a.B和D都不溶于水,也不溶于酸;
b.A溶于水后,与上述某阳离子反应可生成B,且A溶液与过量氨水反应生成白色沉淀
c.C溶于水后,与上述某阳离子反应可生成D,且C溶液与过量氨水反应生成白色沉淀
d.E溶于水后,与上述某阴离子反应可生成B;
e.A溶液与适量E溶液反应生成沉淀,再加过量E溶液,沉淀是减少,但不消失。
请根据上述实验结果,填空:
⑴写出化合物的化学式:A , C,D, E 。
⑵A溶液与过量E溶液反应后,最终得到的沉淀的化学式是。
现有m g某气体,它由四原子分子构成,它的摩尔质量为M g/mol。则:
(1)该气体的物质的量为________mol。
(2)该气体中所含的原子总数为______个。
(3)该气体在标准状况下的体积为______L。
(4)该气体溶于1 L水中(不考虑反应),其溶液中溶质的质量分数为______。
(5)该气体溶于水后形成V L溶液,其溶液的物质的量浓度为______mol/L