“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)CO2的电子式为 。
(2)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ C+ ___ KMnO4+ ____ H2SO4 = ____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O。
(3)甲醇是一种新型燃料,工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+ 2H2(g) CH3OH(g) △H1=-116 kJ·mol-1。
CH3OH(g) △H1=-116 kJ·mol-1。
已知: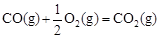 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1
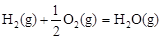 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程式为 。
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的燃料电池装置。
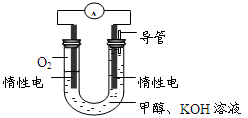
①该电池负极的电极反应为: 。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为 。
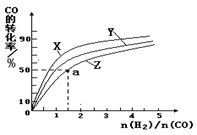
(5)在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。利用图中a点对应的数据,计算出曲线Z在对应温度下 CO(g)+ 2H2(g) CH3OH(g)的平衡常数K = 。
CH3OH(g)的平衡常数K = 。
(6)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10-5 mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族.
(1)D在周期表中的位置;B的原子核外电子排布示意图;
(2)E元素形成最高价氧化物对应水化物的化学式为;
(3)元素C、D、E形成的原子半径大小关系是(用元素符号表示)。
(4)C、D可形成化合物D2C2,D2C2含有的化学键是;
(5)A、C两种元素形成的原子个数之比为1:1的化合物电子式;
(6)B的氢化物与B的最高价氧化物的水化物反应的离子方程式。
Ⅰ.按要求填空(每空1分)
①KOH的电子式:②NH4Cl的电子式:
③CO2的结构式:④HClO的结构式:
Ⅱ.按要求填空(每空2分)
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa(25℃时)时,已知0.5mol液态肼与足量氧气反应,生成氮气和水蒸气,放出312 KJ的热量。N2H4完全燃烧反应的热化学方程式是;又已知H2O(l)==H2O(g);△H = +44kJ∙mol-1,由64g液态肼与氧气反应生成液态水时放出的热量是kJ。
已知物质A分子式为C3H4O2,显酸性。F为由七个原子组成的环状结构,分子式为C6H8O4 。请根据以下框图回答问题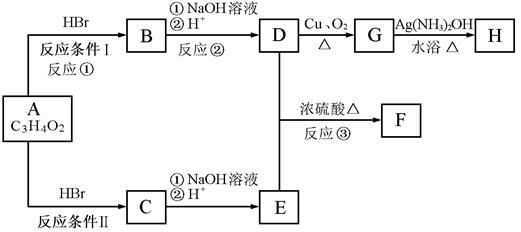
(1)A的结构简式为
(2)反应①的反应类型为
(3)化合物B中含氧官能团的名称是
(4)D和E生成F的化学方程式
D和E按照1:1反应也可生成高聚物,请写出生成该高聚物的化学反应方程式:
(5)G生成H的化学方程式
(6)写出C的同分异构体中属于酯类物质的结构简式、、(至少写3个)
某有机物A含有C、H、O三种元素,其蒸气密度是相同条件下H2密度的29倍,把1.16g该有机物在O2中充分燃烧,将生成物通过足量碱石灰,碱石灰增重3.72g,又知生成的CO2和H2O的物质的量之比为1:1 。
(1)有机物A的分子式
(2)该有机物的红外光谱显示该分子是有一个羟基,无甲基的链状结构,请写出A的结构简式 。
(3)已知聚乳酸 是一种很有前途的可降解高分子材料,可制成袋子替代日常生活中的大部分塑料袋。请完成以有机物A为原料合成聚乳酸的路线(无机试剂任选)
是一种很有前途的可降解高分子材料,可制成袋子替代日常生活中的大部分塑料袋。请完成以有机物A为原料合成聚乳酸的路线(无机试剂任选)
|

(1)为实现以下各步的转化,请在括号中填入适当的试剂
①②③④⑤
(2)分子式为C4H10O的有机化合物,能在催化剂作用下连续氧化生成羧酸,请写出它可能的结构简式为_____________ 、_____________ 。当C与4个不同的原子或基团相连时该碳原子称作“手性”碳原子。则分子式为C4H10O的有机化合物中,含有“手性”碳原子的结构简式为________________。该有机物的系统命名为: