化学兴趣小组同学运用类比学习的思想,探究过氧化钠与二氧化硫的反应。小组同学改进了下图所示的装置进行实验制取SO2的反应。充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃。试回答下列问题: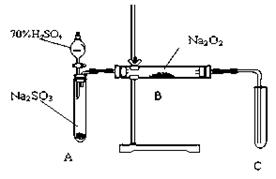
(3)  请你完成装置改进的措施和理由:
请你完成装置改进的措施和理由: ①措施:在A、B之间加一个干燥管,
①措施:在A、B之间加一个干燥管, 作用_______________________________________。
作用_______________________________________。 ②措施:为确保C中的实验现象发生,在B、C之间加一个装有_________________的洗气瓶,
②措施:为确保C中的实验现象发生,在B、C之间加一个装有_________________的洗气瓶, 作用_______________________。
作用_______________________。
(2)某同学推断该白色固体为Na2SO3,则其化学反应方程式是____________________________。
(3)任何的推论都要经过检验,请完成对白色固体成分的探究:
限选实验仪器与试剂:烧杯、试管、药匙、滴管、酒精灯、带单孔胶塞的导管、棉花、试管夹;3 mol·L-1HCl、6 mol·L-1HNO3、NaOH稀溶液、蒸馏水、1 mol·L-1 BaCl2溶液、澄清石灰水、品红溶液。
① 提出合理假设:
假设1:白色固体为Na2SO3; 假设2: ;
假设3:白色固体为Na2SO3与Na2SO4的混合物。
② 设计实验方案证明以上三种假设,并按下表格式写出实验操作步骤、预期现象与结论。
| 实验操作 |
预期现象与结论 |
| 步骤1:取少量白色固体于试管,加入 ,塞上单孔胶塞,将生成的气体通入 。 |
若 ,说明白色固体含有Na2SO3,则 成立,若无该现象, 则 成立。 |
| 步骤2:在步骤1反应后的溶液加入 。 |
若 ,则说明白色固体含Na2SO4。 结合步骤1的结论,则 成立,若无该现象,则 则 成立。 |
实验室里用乙醇和浓硫酸反应生成乙烯,进而制取1,2-二溴乙烷。
(1)用下列仪器(短接 口或橡皮管均已略去)完成该实验,若气体流向为从左到右,则正确的连接顺序是:
口或橡皮管均已略去)完成该实验,若气体流向为从左到右,则正确的连接顺序是:
B经A(1)插入A中,D接A(2);A(3)接______接______接______接______。
(2)温度计水银球的正确位置是___________ ____________________。
____________________。
(3)D与分液漏斗相比,其主要优点是________________________________。
(4)E装置烧杯中的冷水和反应管内液溴上的水层作用均是________________,若将装置F拆除,在E中的主要副反应为_________________________________。
(5)若要准确测定乙烯的产量,下列方案可行的是_____________________。
方案I:将E及其后面的装置拆除后,连接图28—1所示装置进行实 验,反应结束后,测其实验前后的质量,由此得到乙烯产量。
验,反应结束后,测其实验前后的质量,由此得到乙烯产量。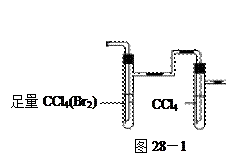 方案II:将E及其后面的装置拆除后,连接图28—2所示装置进行实验,反应结束后,测得乙烯的体积,由此算得乙烯产量。
方案II:将E及其后面的装置拆除后,连接图28—2所示装置进行实验,反应结束后,测得乙烯的体积,由此算得乙烯产量。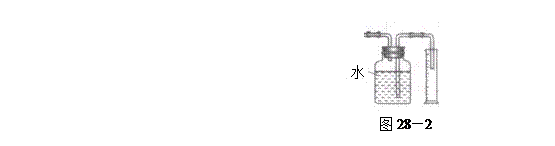
某化学课外小组用右图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。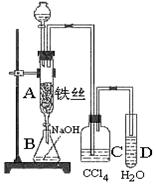
(1)写出A中反应的化学方程式:。
(2)观察到A中的现象是。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是,写出有关的化学方程式。
(4)C中盛放CCl4的作用是。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入,现象是。
某课外小组在实验室制备氨气,并进行有关氨气的用途及性质的探究。
(1)写出实验室制取氨气的化学方程式:。
(2)合成氨对化学和国防工业具有重要意义。写出氨的两种重要用途:
①②。
(3)该小组同学设计下图所示装置探究氨气的还原性。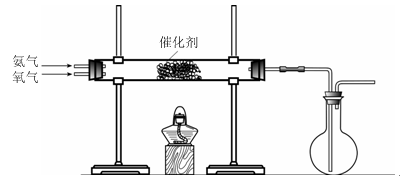
①氨催化氧化的化学方程式为。
②若实验时通入氨气的速率过快,在烧瓶中会出现白烟,该物质的化学式为。
(4)该小组同学欲以氨气和二氧化碳为原料制备少量较纯净的碳酸铵溶液设计如下甲乙两方案。
①甲方案:先将二氧化碳通入水中,充分溶解后,再通入氨气;
乙方案:先将氨气通入水中,充分溶解后,再通入二氧化碳。
合理的方案是:,理由是。
②检验产物中有NH4+的方法为。
③用氢键表示式写出氨水中存在的所有氢键。
甲、乙、丙、丁是由前20号元素组成的物质,它们之间存在如下转化关系。
甲+乙 → 丙+丁
(1)转化关系中所涉及的反应为非氧化还原反应,且乙为水。若甲为块状固体,丙为可燃性气体,其分子内既含有极性键又含有非极性键。则丙的电子式是。
(2)转化关系中所涉及的反应为氧化还原反应,且乙为水。
① 若甲和丙是同主族元素组成的单质,且组成甲的元素位于第三周期,此反应的离子方程式是。
② 若丙和丁都可在一定条件下还原CuO,此反应的化学方程式是。
③ 若甲是由N和O元素组成的气态物质,呈红棕色。将3.36 g Fe加到一定量丙溶液中,收集到1.12 L气体丁(已折算为标准状况),则反应的离子方程式是:
。
(3)若甲+乙 → 丙+丁仅表示置换反应,其中:甲丁为单质乙丙为化合物请写出满足以下要求的3个置换反应的化学方程式:① 所涉及的元素的原子序数小于20 ② 6种单质分属6个不同的主族
① ② ③
工业上以锂辉石(Li2O·A12O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下: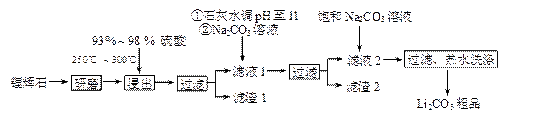
已知:① Li2O·Al2O3·4SiO2 + H2SO4(浓) Li2SO4 + Al2O3·4SiO2·H2O↓
Li2SO4 + Al2O3·4SiO2·H2O↓
| T/℃ |
20 |
40 |
60 |
80 |
| S(Li2CO3)/g |
1.33 |
1.17 |
1.01 |
0.85 |
| S(Li2SO4)/g |
34.2 |
32.8 |
31.9 |
30.7 |
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤Ⅱ中反应的离子方程式是______。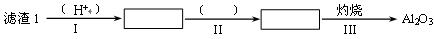
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3写出生成滤渣2反应的离子方程式: 。
。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
①将粗产品Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择半透膜隔开,用惰性电极电解。阳极的电极反应式是。
②电解后向产品LiOH溶液中加入过量NH4HCO3溶液生成Li2CO3反应的化学方程式是。