暖宝宝是一种防寒用品,如图所示。暖宝宝中的主要成分有哪些?发热的原因是什么?
(1)小明探究:暖宝宝中的主要成分是什么?
剪开内包装袋,倒出其中的粉末,发现呈黑色。
【提出猜想】该黑色粉末可能含有炭粉、铁粉、二氧化锰、氧化铜、四氧化三铁中的一种或几种。
【初步验证】将磁铁靠近黑色粉末,部分被吸引。
【查阅资料】四氧化三铁具有磁性,能被磁铁吸引;炭粉、二氧化锰不与稀硫酸;氧化铜与稀硫酸反应后溶液呈蓝色。
【得出结论】该黑色粉末可能含有(写物质的名称) 。
【进行实验】
| 实验编号 |
实验操作 |
实验现象 |
| ① |
取黑色粉末加足量稀硫酸 |
固体部分溶解,有气泡产生,溶液无蓝色 |
| ② |
取实验①的残渣灼烧,将内壁涂 有澄清石灰水的小烧杯罩在上方 |
澄清石灰水变浑浊 |
由实验①可知,该黑色粉末中肯定含_____________,肯定不含______________。
由实验②可知,该黑色粉末肯定含 ,写出实验②中澄清石灰水变浑浊的化学
反应方程式_________________________。
(2)小明思考:暖宝宝为什么会发热?
【查阅资料】暖宝宝中的铁粉在空气中发生了缓慢氧化,进而放出热量。由此可见,
人们可以利用化学反应放出的能量,请再举一例:___________________。
(3)人们利用化学反应还可以_______________________。
(4)向盛有100g稀盐酸的烧杯中加入足量的铁粉,充分反应后,得到0.5g氢气。试100g稀盐酸中溶质的质量分数。
请完成下列相关内容:
Ⅰ.实验表明,大多数金属都能与氧气发生反应,但反应的难易和剧烈程度是不同的。
(1)铁在潮湿的空气中易生锈,铁锈的主要成分为;铁在氧气中能剧烈燃烧,现象为,反应的化学方程式为。
(2)铜在潮湿的空气中也容易锈蚀生成铜绿,其主要成分是碱式碳酸铜[Cu2(OH)2CO3],铜锈蚀除了与氧气有关外,还与空气中的有关。
(3)铝在空气中具有很好的抗腐蚀性能,其原因是。
Ⅱ.过氧化钠(Na2O2)是一种淡黄色固体,能与水或二氧化碳反应放出氧气。实验室有一瓶放置了较长时间的过氧化钠粉末,已知发生了部分变质,同学们取3.00g变质粉末决定探究其中的成分。
【提出问题】变质的过氧化钠粉末中有哪些成分?
【查阅资料】2Na2O2+2H2O═4NaOH+O2↑
2Na2O2+2CO2═2Na2CO3+O2
【猜想与假设】(1)粉末成分是Na2O2和NaOH的混合物
(2)粉末成分是的混合物
(3)粉末成分是Na2O2、NaOH 和Na2CO3的混合物
……
【实验探究】
| 实验步骤 |
实验现象 |
实验结论 |
| ①取3.00g变质粉末于一支大试管中,加入适量的水,共收集到0.32g气体,然后用带火星木条检验生成的气体。 |
固体完全溶解, |
该固体样品中含有Na2O2,其质量为g。 |
| ②继续向上述试管中加入足量的石灰水,充分反应。 |
化学方程式。 |
|
| ③将②中物质过滤,得到滤渣,将其洗涤、干燥并称量,得固体1.00g。 |
【得出结论】同学们经过实验和计算分析,该固体样品中所含物质有。
【拓展应用】过氧化钠(Na2O2)是供氧设备中常用的供氧剂。若将15.6g过氧化钠与足量的二氧化碳充分反应,理论上生成的氧气质量是多少?(写出计算过程)。
(13分)某兴趣小组对鸡蛋壳的主要成分和含量进行了探究。
I.定性探究
实验一:探究鸡蛋壳的主要成分
【查阅资料】鸡蛋壳中含钙元素。
【实验步骤和现象】取一些鸡蛋壳予一支洁净的试管中,加入过量稀盐酸,产生无色无气味的气体,将该气体通入澄清石灰水中,石灰水变浑浊。
【结论】
写出该气体通入澄清石灰水中的化学反应方程式
实验二:做无壳鸡蛋
【实验步骤和现象】如图所示:将一个新鲜鸡蛋放入水中,鸡蛋沉入水底。加入量浓盐酸后,鸡蛋会出现上浮、下沉、再上浮、再下沉的现象,反复多次。最后变成无壳鸡蛋。
【解释与交流】用化学和物理知识解释鸡蛋上浮、下沉多次的原因
Ⅱ.定量探究
化学兴趣小组为了测定鸡蛋壳中主要成分的含量(其它成分不溶于水也不与酸反应)做如下实验。取用2.00 g鸡蛋壳样品,把20.00 g稀盐酸分4次加入样品中,充分反应后过滤,取滤渣,洗涤、干燥、称量,得实验数据如下:
| 稀盐酸的用量 |
剩余固体的质量 |
| 第一次加入5.00 g |
1.50 g |
| 第二次加入5.00 g |
1.00 g |
| 第三次加入5.00 g |
0.50 g |
| 第四次加入5.00 g |
0.30 g |
(1)从以上数据可知,这四次实验中,第次样品中主要成分已完全反应。
(2)(3)计算过程中和最后数字精确到0.01,若是百分数,则精确到0.1%]
(2)求鸡蛋壳中主要成分的含量和所用稀盐酸的溶质质量分数(写出计算过程)。
(3)在上述实验所得滤液中加30.00g水,加入g氢氧化钙能使溶液pH等于7。此时,所得溶液的溶质质量分数为。
(4)用36.5%的浓盐酸配制20.00g上述稀盐酸需加水的体积为(保留一位小数)。
某校化学小组对热水壶底部水垢的主要成分进行了如下探究,请完成以下活动并回答相关问题。
【查阅资料】
天然水中含有Ca2+、Mg2+、HCO3-等离子,在加热条件下,这些离子趋于生成溶解度更小的物质——水垢(主要成分为碳酸盐和碱)。有关物质的溶解性见下表(20℃):
| 阴离子 阳离子 |
OH- |
CO32- |
HCO3- |
| Ca2+ |
微溶 |
不溶 |
可溶 |
| Mg2+ |
不溶 |
微溶 |
可溶 |
根据上述物质的溶解性,小组同学确定水垢的主要成分中一定含有的两种物质是,可能含有Ca(OH)2和MgCO3。
【提出问题】水垢的主要成分中是否含有Ca(OH)2和MgCO3呢?
【实验方案1】确定水垢中是否含Ca(OH)2
| 实验步骤 |
实验现象 |
结论 |
| 在少量研碎的水垢中,加入适量的蒸馏水充分搅拌,过滤,在滤液里加入Na2CO3溶液。 |
_______________ |
水垢中无Ca(OH)2 |
【实验方案2】确定水垢中是否含MgCO3
利用下列实验装置,完成实验2探究。其主要实验步骤如下: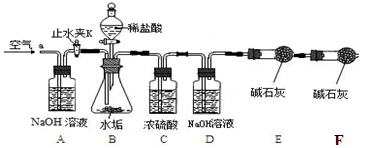
按上图组装后,将9.8g水垢试样放入锥形瓶中,打开止水夹K,从导管a处缓缓鼓入空气,一段时间后精确称量D、E装置总质量为600.0g关闭止水夹K,加入足量稀盐酸溶液,待锥形瓶中不再产生气泡时,打开止水夹K,从导管a处再次缓缓鼓入空气,一段时间后称量装置D、E的总质量为604.4g(注意:碱石灰主要成分为CaO和NaOH的混合物)。
【实验讨论】
(1)加入药品前应;待锥形瓶中不再产生气泡时,打开止水夹K,缓缓鼓入空气的目的是。
(2)C装置的作用是: __。
(3)装置B中生成CO2的质量为g。通过计算说明该水垢中(填序号)含MgCO3。
A.一定B.一定不C.可能D.无法确定
【实验方案3】定量探究水垢中氢氧化镁的质量分数
另取质量为9.8g的水垢试样,加入7.3%稀盐酸与之恰好完全反应,测得消耗稀盐酸110 g。结合以上数据和实验结论,计算水垢样品中氢氧化镁的质量分数(写出计算过程,结果保留1位小数)。
【反思】缺少F装置会使所测水垢样品中氢氧化镁的质量分数 _____________(填写“偏大”或“偏小”或“不变”)。
如图为“хх”钙片商品标签图,请根据标签的有关信息完成下列各题.
该钙片主要成分碳酸钙,碳酸钙的相对分子质量为①.
某校化学兴趣小组为了确认标签中碳酸钙的含量是否真实,决定通过实验进行探究.
实验目标:测定该钙片主要成分碳酸钙的含量.
实验原理:取一定质量的钙片与足量的稀盐酸反应,测量生成的CO2的质量(已知该状态下CO2的密度),然后计算其中碳元素的质量,利用反应前后碳元素的质量不变,再计算出碳酸钙的质量.
实验方案:兴趣小组的同学们经过思考提出了以下几种实验方案,请你参与他们对实验方案的讨论、取舍.
方案一:甲同学设计了如图所示的装置,通过反应后右侧注射器(注射器最大量程为20mL)内收集到气体的量来进行计算.
(1)同学们观看了他的设计后,都认为该方案中样品的取用的量需要一定的控制,这是因为.
(2)同学们讨论后,一致认为注射器的摩擦会影响生成的CO2的完全收集.
方案二:乙同学设计了如图所示的装置,与甲同学的相比,仅仅在收集方法上不同.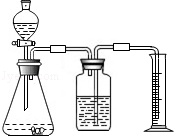
(1)同学们观看了他的设计后,都认为所测得CO2气体的体积将会①(填偏大或偏小),你认为他们的理由是②,你的改进方案是③;广口瓶内原有的空气对实验结果④(填“有”或“没有”)影响.
(2)同学们讨论后,一致认为把装置改进后测得生成的CO2气体体积会偏大,你认为他们的最主要理由是.
方案三:丙同学设计了如图所示的装置.同学们观看后一致认可他的设计,并按照他的思路设计了以下实验步骤.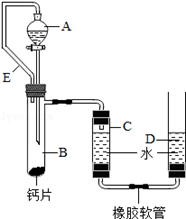
实验步骤:
①连接装置并检查装置气密性;
②加入10片钙片和水;
③记录C中液面刻度(C为带有刻度的玻璃管);
④由A向B中滴加稀盐酸至过量;
⑤待B中不再有气体产生并恢复至室温后,记录C中液面刻度,计算得到气体的体积为V mL(经查,该气体密度为ρg/L);
⑥计算气体的质量.
实验反思:
(1)丙同学在实验前将钙片全磨成粉末状,你认为他的目的是:;
(2)检查该装置的气密性时,如图准备好装置,在C、D两管中装好水且液面相平,提高D管,,则气密性良好;
(3)实验结论:经多次实验(钙片都是10片),所得CO2气体的平均质量是6.82g,请你最后计算确认标签中碳酸钙的含量是(填“真实”或“不真实”)的.(最后一空不需要写计算过程)
(5分)“海水晒盐”所获得的粗盐中,除含有泥沙等难溶性杂质外,还含有氯化镁、氯化钙等可溶性杂质,某化学小组为得到较纯净的食盐,进行了下列实验探究活动,请参与他们的探究活动:
【提出问题】如何获得较纯的食盐晶体?
【查阅资料】 20℃时,部分物质的溶解性情况如下表所示:
| OH﹣ |
CO32﹣ |
|
| Na+ |
溶 |
溶 |
| Ca2+ |
微 |
不 |
| Mg2+ |
不 |
微 |
【实验方案】按如图方案进行提纯粗盐.
【解释与结论】
(1)操作X的名称是.
(2)沉淀D是.
(3)实验步骤③的主要目的是(用化学方程式回答);
判断氢氧化钠溶液已过量的方法是.
【反思与评价】
(4)有同学认为该实验方案并不完善,其理由及需补充的实验操作是.