(1)控制变量是科学研究中的重要研究方法,其基本思路是,在实验研究中人为只改变一个因素(调节变量),其他因素保持相同,观察测定因调节变量改变而改变的因素(因变量),从而分析得到研究结论。中学化学中应用控制变量的方法研究问题的例子很多。请分析或设计:
①在研究浓度对化学反应速率的影响时,教材安排了利用Na2S2O3与H2SO4反应的一组对照实验(Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O)
| 烧杯 编号 |
加3% Na2S2O3溶液体积(mL) |
加H2O体积(mL) |
加(体积之比为1∶2)H2SO4溶液体积(mL) |
所需时间(s) |
| 1 |
5 |
5 |
2 |
|
| 2 |
7 |
3 |
2 |
|
| 3 |
10 |
0 |
2 |
|
在三个烧杯(底部有黑色“十”字标记)内分别加入表中所示体积的三种液体,搅拌并开始计时,到出现浑浊使烧杯底部“十”字看不见时停止计时。比较所需时间,得出浓度对化学反应速率影响的结论。实验中,温度和反应体系中硫酸浓度是保持相同的因素,调节变量是____________________,因变量是______________。
②运用控制变量原理设计实验,利用纯碱溶液探究温度对盐的水解的影响,简述实验方法:________________________________________________________________________。
(2)373 K时,H2PO3-与OH-发生如下反应:
H2PO3-+OH-HPO32-+H2O
反应结果如表所示:
| H2PO3-起始浓度(mol/L) |
0.10 |
0.50 |
0.50 |
| OH-起始浓度(mol/L) |
1.00 |
1.00 |
4.00 |
| 反应速率[mol/(L·s)] |
3.2×10-5 |
1.60×10-4 |
2.56×10-3 |
如果用v=kcm(H2PO3-)·cn(OH-)表示反应速率(k为与浓度无关的常数)
①k=________,m=________,n=________。
②若c(H2PO3-)的起始浓度为0.20 mol/L,c(OH-)的起始浓度为1.50 mol/L,则反应速率v=________。
(15分)某研究小组从一含锌废渣(质量百分组成:40.5%ZnO 、19.5%CuO、5.7%FeO、7.3% Fe2O3,其余为SiO2)中回收锌和铜,设计以工业废酸(含15%的H2SO4)为酸浸液的方案,其流程如下图(部分条件略):已知碱式碳酸锌的化学式为Zn(OH)2·ZnCO3。
部分离子以氢氧化物形式开始沉淀和沉淀完全时的pH如下表:
| 离子 |
Fe2+ |
Fe3+ |
Cu2+ |
| 开始沉淀时的pH(初始浓度为1.0 mol/L) |
6.5 |
1.5 |
4.2 |
| 沉淀完全时的pH |
9.7 |
3.2 |
6.7 |
请回答下列问题:
(1)常温下二价锌在水溶液中的存在形式与pH的关系如图,横坐标为溶液的pH,纵坐标为Zn2+ 或Zn(OH)42-(配离子)物质的量浓度的对数(假设Zn2+离子浓度为10-5mol•L-1时,Zn2+离子已沉淀完全).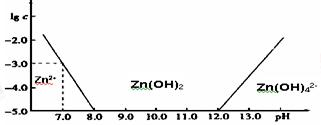
利用图中数据计算,Ksp[Zn(OH)2]=。
(2)写出试剂a、b的化学式:a:;b:。
(3)写出加入H2O2后发生反应的离子反应方程式:。
(4)写出沉锌过程中的离子反应方程式:,沉锌后溶液中主要溶质的化学式是。
(5)将碱式碳酸锌加热分解可得到具有催化性能的活性氧化锌,可用于催化尿素与甲醇合成碳酸二甲酯(DMC)的反应。写出碱式碳酸锌受热分解的化学方程式。
(6)利用氯化锌溶液与碳酸钠溶液反应制得的碳酸锌中混有碱式碳酸锌,某同学取一定质量的该固体,灼烧至恒重,能否通过固体质量的减少量来确定固体的成分?_______ (填“能”或“否”)
某研究性学习小组探究碳化铝的性质:发现碳化铝与水在常温下剧烈反应,生成大量气体和白色沉淀,该沉淀既能溶于盐酸也能溶于NaOH溶液,该小组同学为了探究气体产物的组成,设计出如下实验: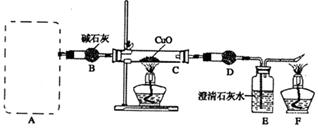
(1)利用碳化铝制取气体,下列装置中适合作为气体发生装置的是。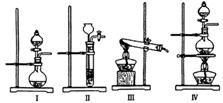
(2)正确选择发生装置后,连接装置进行实验。一段时间后,硬质玻璃管C中黑色粉末变成红色,干燥管D中白色粉末变成蓝色,装置E中澄清石灰水变浑浊,尾气燃烧产生蓝色火焰。
①干燥管D中的试剂可能是,其作用是。
②根据实验现象,某同学得出下列推论,其中正确的是。
a.气体与氧化铜在一定条件下反应,氧化产物只有二氧化碳
b.气体与氧化铜在一定条件下反应,产物一定有水和二氧化碳,可能有一氧化碳
c.气体与氧化铜在一定条件下反应,产物一定有水、二氧化碳和一氧化碳
d.气体具有还原性,氧化产物可能有多种
(3)实验完毕后,要先后熄灭C和F处的酒精灯,应先熄灭的是处酒精灯,理由是。(只写出一条即可)
(4)若最后在F处点燃气体与在A处产生的气体相同,实验前系统内的空气已排尽,实验验结束后,C装置减轻12.8 g,D装置增重7.2 g,E装置增重8.8 g(假定D、E吸收气体是完全的),则A、C处发生反应的方程式分别为、。
(5)如图所示,U型透明玻璃管的左端封闭有A处产生气体和氯气的混合气,将该装置放在日光灯下。一段时间后(不考虑水与氯气的反应),下列关于U型管中可能出现的现象的叙述中正确的是()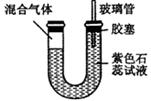
a.U型管左侧会有油状液滴出现
b.溶液很快变成蓝色
c.气柱缩小,右端液柱下降
d.气柱膨胀,右端玻璃管中液体溢出
亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒,国际上对食品中亚硝酸钠的用量控制在很低的水平上。某学习小组针对亚硝酸钠设计了如下实验:
【实验I】制备NaNO2
该小组查阅资料知:2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3
设计制备装置如下(夹持装置略去):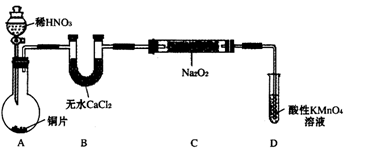
(1)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式为 。
(2)如果没有B装置,C中发生的副反应有 。
(3)甲同学检查完装置气密性良好后进行实验,发现NaNO2的纯度较低。乙同学对上述装置进行适当改进后提高了NaNO2的纯度,其改进措施是 。
(4)丙同学对B中的药品进行了更换,也提高了NaNO2的纯度。丙更换的药品最好是。
【实验Ⅱ】测定甲、乙同学制取的样品中NaNO2的含量
步骤:a.在5个有编号的带刻度试管(比色管)中分别加入不同量的NaNO2溶液,各加入1 mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10 mL并振荡,制成标准色阶: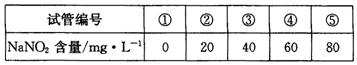
b.分别称量0.10 g甲、乙制得的样品溶于水配成500 mL溶液,贴上标签甲、乙。再分离别取5 mL甲、乙待测液,各加入1 mL M溶液,均加蒸馏水至10 mL振荡,分别与标准色阶比较。
(5)步骤b中比较结果是:甲待测液颜色与③号色阶相同,乙待测液颜色与④号色阶相同。则甲同学制得的样品中NaN02的纯度是%。
(6)用目视比色法证明维生素C可以有效降低NaNO2的含量。设计并完成下列实验报告。
已知SO2可以用Fe(NO3)3溶液吸收,某学习小组据此按下图装置展开如下相关探究:取一定量的铜片于三颈烧瓶中,通入一段时间N2后再加入足量的浓硫酸,加热。装置A中有白雾(硫酸酸雾)生成,装置B中产生白色沉淀。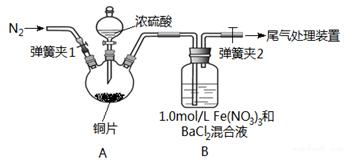
回答下列问题:
(1)装置A中用于添加浓硫酸的仪器名称为;检查图中连通装置A、B气密性的方法是。
(2)加入浓硫酸之前先通人N2一段时间,其目的是;排除装置A中白雾影响,可在装置A、B间增加洗气瓶C,则C中盛放的试剂是。若用氢氧化钠溶液处理尾气,则发生反应的离子方程式为。
(3)经过讨论,该小组对装置B中产生沉淀的原因,提出下列假设(不考虑各因素的叠加):
假设1:装置A中白雾进入装置B中参与了反应。
假设2:。
假设3:Fe(NO3)2溶液显酸性,在此酸性条件下NO3‾能氧化SO2。
(4)请你设计实验验证上述假设3,写出实验步骤、预期现象和结论。
| 实验步骤(简述操作过程) |
预期现象和结论 |
| ①测1.0mol•L‾1Fe(NO3)3溶液的pH; ② ③ ④ |
(13分)过氧化钙是一种新型的多功能无机化工产品,常温下是无色或淡黄色粉末,易溶于酸。难溶于水、乙醇等溶剂。某实验小组在实验室用钙盐制取Ca02·8H20沉淀(该反应是一个放热反应)。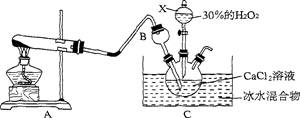
(1)仪器X的名称是。将装置A与B连接后要检查气密性,检查气密性的方法为
(2)仪器B的作用是。
(3)写出A中发生反应的化学方程式:。
(4)制取CaO2·8H20一般在0~5℃的低温下进行,原因是.生成CaO2·8H20的 化学方程式为。
(5)2.76 g CaO2·8H20样品受热脱水过程的热重曲线(样品质量随温度变化的曲线,140℃时完全脱水,杂质受热不分解)如图所示。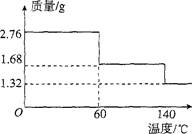
①试确定60℃时CaO2·xH20中x=。
②该样品中CaO2的质量分数为。