(1)P4(白磷,s)+5O2(g)══ P4O10(s) ΔH=-2983.2kJ/mol
P(红磷,s)+5/4O2(g)══ 1/4 P4O10(s) ΔH=-738.5kJ/mol
则白磷转化为红磷的热化学方程式为 ,
相同状况下,红磷的稳定性比白磷 (填“强”、“弱”或“无法判断”)
(2)在原电池中,通常较活泼的金属做 极,发生 反应;
电解池中,与电源正极相连的极是 极,发生 反应。
(3)右图所示水槽中试管内有一枚铁钉,放置数天后观察:
①若试管内液面上升,发生 腐蚀,正极反应式为 。
②若试管内液面下降,发生 腐蚀,正极反应式为 。
(1)稀有气体不能形成双原子分子是因为。
(2)多电子原子中,在离核较近的区域内运动的电子能量(填较高或较低)。
(3)不含中子的核素的核组成符号为。
(4)ⅥA族氢化物中沸点最低的是(写化学式)。
(5)在金属元素与非金属元素的分界线附近可以寻找制备材料的元素;在
中可寻找制备催化剂及耐高温、耐腐蚀的元素。
(6)下列选项中,随原子序数递增而呈周期性变化的是(填序号,后同);其中,起决定性作用的是
A.原子核外电子排布,B.原子半径,C.主要化合价,D.元素的金属性或非金属性。
(7)下列核素中,用于考古时测文物年代的是(填序号)。
A.2H和3H, B.14C, C.235U。
(8)下列实验中,可产生白烟的是(填序号)。
A.氢气与氯气反应,B钠与氯气反应。
(9)下列反应中,更剧烈的是(填序号)。
A.钠与水反应,B.钾与水反应。
(10)取下列溶液分装两试管,再分别依次加入少量氯水和少量四氯化碳,用力振荡、静置后,四氯化碳层显橙红色的是(填序号)。
A.溴化钠溶液,B.碘化钾溶液。
(11)用电子式表示MgCl2的形成过程。
下表是元素周期表的一部分,回答下列有关问题: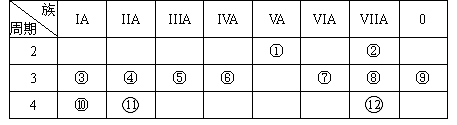 1
1
(1)写出下列元素符号:①________,⑥________,⑦________。
(2)画出原子的结构示意图:④________,⑤________,⑧________。
(3)在这些元素中,最活泼的金属元素是________,最活泼的非金属元素是________,最不活泼的元素是________。(均用元素符号表示)
(4)在这些元素的最高价氧化物对应水化物中,酸性最强的是________,碱性最强的是________,呈两性的氢氧化物是________。(均写出物质的化学式)
X、Y、Z、T为短周期的四种元素,其最高正价依次为+1、+4、+5、+7,核电荷数Y<Z<X<T,则
(1)元素符号XYZT;
(2)写出X的最高价氧化物对应水化物与Z的最高价氧化物对应水化物反应的离子方程式;
(3)按碱性减弱酸性增强的顺序,写出各元素最高价氧化物对应水化物的化学式为
A、B、C、D、E五种元素在周期表里的位置如下表所示:A、B、C为同主族元素,A为该族中原子半径最小的元素;D、B、E为同周期元素,E为该周期中原子半径最小的元素。D元素名称是 ,在周期表第 周期,第 族,其原子结构示意图 。
| A |
||
| D |
B |
E |
| C |
A+、B―、C、D四种微粒中均有氢原子,且电子总数均为10个。溶液中的A+和B―在加热时相互反应可转化为C和D。则A+是 ,B―是 ,C是______,D是______。