下列离子方程式正确的是( )
| A.向NaHCO3溶液中加入过量石灰水:2HCO3-+Ca2++2OH-===CaCO3↓+CO32-+2H2O |
| B.向AlCl3溶液中滴加过量氨水:Al3++4NH3·H2O="==" AlO2-+4NH4++2H2O |
| C.氯气通入水中:Cl2+H2O===2H++Cl-+ClO- |
| D.FeCl3溶液腐蚀铜质线路板:Cu+2Fe3+===Cu2++2Fe2+ |
已知反应:2SO2(g)+O2(g) 2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)、温度(T)等条件的变化关系如下图所示.则下列说法正确的是
2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)、温度(T)等条件的变化关系如下图所示.则下列说法正确的是
| A.由图甲知,A点SO2的平衡浓度为0.4 mol/L |
| B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2:1:2 |
| C.压强为0.50 MPa时不同温度下SO2转化率与温度关系如图乙,则T2>T1 |
| D.达平衡后,缩小容器容积,则反应速率变化图象可以用图丙表示 |
已知:CO(g)+Cl2(g) COCl2(g)△H<0,当反应达到平衡时,下列措施中能提高Cl2转化率的是①升温 ②降温 ③增加CO浓度 ④加压 ⑤加催化剂 ⑥恒压通入惰性气体
COCl2(g)△H<0,当反应达到平衡时,下列措施中能提高Cl2转化率的是①升温 ②降温 ③增加CO浓度 ④加压 ⑤加催化剂 ⑥恒压通入惰性气体
| A.①④⑤ | B.②③④ | C.②④⑤ | D.③⑤⑥ |
如图所示可逆反应:mA(g)+nB(g) xC(g),△H="Q" kJ/mol,在不同温度、压强下反应物A的转化率的变化情况.下列对于反应的热效应Q和反应方程式A、B、C的化学计量数的判断中,正确的是
xC(g),△H="Q" kJ/mol,在不同温度、压强下反应物A的转化率的变化情况.下列对于反应的热效应Q和反应方程式A、B、C的化学计量数的判断中,正确的是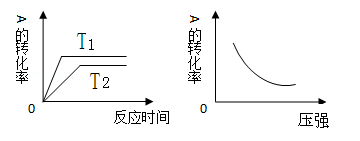
A.Q<0,m+n<x B.0,m+n>x
C.Q>0,m+n<x D.Q>0,m+n>x
反应4NH3+5O2 4NO+6H2O在一定体积的密闭容器中进行,20s后NO的物质的量浓度增加了2mol/L,则下列反应速率正确的是
4NO+6H2O在一定体积的密闭容器中进行,20s后NO的物质的量浓度增加了2mol/L,则下列反应速率正确的是
| A.v (NO)="0.02" mol•(L•s)﹣1 |
| B.v (NO)=0.2mol•(L•s)﹣1 |
| C.v (NH3)="0.1" mol•(L•s)﹣1 |
| D.v (NH3)="0.01" mol•(L•s)﹣1 |
一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g) 2C(g)△H<0,反应过程中B、C的物质的量随时间变化关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图下列有关说法不正确的
2C(g)△H<0,反应过程中B、C的物质的量随时间变化关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图下列有关说法不正确的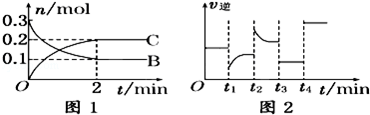
A.反应开始2分钟内,v(B)=0.05mol/(L•min)
B.t1时改变的条件可能是减小了反应物的浓度
C.t2时可能升高了温度,t3时改变的条件可能是降压,此时c(B)减小
D.T4时可能使用了催化剂