某学习探究小组用水电解器电解水,测定两管逸出气体的体积,记录如下:
| 时间/分钟 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
| 连电源负极的管(A)中气体体积/mL |
6 |
12 |
20 |
29 |
39 |
49 |
59 |
69 |
| 连电源正极的管(B)中气体体积/mL |
2 |
4 |
7 |
1l |
16 |
21 |
26 |
31 |
请回答:
(1)写出电解水化学变化的文字表达式 ____________ 。
(2)电解器正极的气体是 ,检验方法为 ;负极的气体为 。
(3)装置密闭性良好、读数正确,但电解开始阶段两管气体的体积比不符合理论比值的原因可能是 。
(4)随着反应时间的推移,管(A)和管(B)产生气体的体积比非常接近理论比值,其可能的原因是 _________ 。
化学就在我们身边,它与我们的生活息息相关。
(1)天然水中含有的部分杂质如下表所示,请根据表中内容回答问题。
| 溶解物质 |
悬浮物质 |
|
| 主要气体 |
主要离子 |
细菌、藻类、 泥沙、黏土 |
| 氧气、二氧化碳、硫化氢 |
钙离子、氯离子、硫酸根离子、钠离子 |
①上表中“主要气体”中属于氧化物的气体有种,
②写出“主要离子”中任一种阳离子的符号,
③除去水中“悬浮物质”常用的一种净化操作是,
④若要除去该水样中的颜色和臭味,可加入物质是。
(2)现有H、N、C、O、Hg五种常见的元素,请选用其中的元素写出符合下列要求的物质各一种(用化学式表示)
①人体中含量最多的物质;②能产生温室效应的气体;
③温度计中的一种金属物质;④可充入食品包装中防腐的气体。
(10分)根据如图所示装置回答有关问题: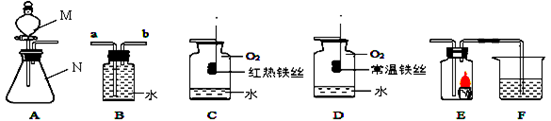
(1)写出下列仪器名称M;N
(2)若用装置B排水收集氧气,气体从(填“a”或“b”)导管通入瓶内;瓶底留少量水进行装置C中的实验,水的作用是.
(3)对比装置D和C,可以得出关于可燃物燃烧的条件是.
(4)某同学连接A、E、F进行实验,A中所加药品不同,F中所加药品相同.
①若实验时E中蜡烛熄灭,F中溶液变浑浊,说明A中产生的气体所具有的性质为.
②若实验时E中蜡烛燃烧更旺,F中溶液变浑浊,则A中反应的化学方程式为.
③C中铁丝燃烧的化学方程式为.
(1)铝元素在自然界中主要以 Al2O3存在,Al2O3属于(填字母序号)。
A.单质 B.氧化物C.金属D.混合物
(2)工业用电解熔融 Al2O3的方法冶炼铝,化学方程式为2Al2O3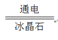 4Al+3O2↑,属于基本反应类型中的反应。
4Al+3O2↑,属于基本反应类型中的反应。
(3)铝可制成蒸锅,主要利用铝的延展性和性.
(4)运载“嫦娥三号”的火箭外壳用到了钛合金,钛合金属于(填“混合物”或“纯净物”)。
(5)PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物。它的直径还不到人的头发丝粗细的1/20,与较粗的大气颗粒物相比,PM2.5粒径小,富含大量的有毒、有害物质且在大气中的停留时间长、输送距离远,因而对人体健康和大气环境质量的影响更大,易引发包括哮喘、支气管炎和心血管病等方面的疾病.抽空多去野(如森林或海边)外走一走,那里的PM2.5值很低.
①PM2.5其实就是我国计入空气首要污染物的(填字母序号);
A.氮氧化物 B.二氧化硫 C.一氧化碳 D.可吸入颗粒物
②今年的11月份至今,许多地区已出现多次灰霾天气,污染比较严重,据统计,冬季是灰霾日相对集中的季节,其原因是_________________________
③在日常生活中,可以减少PM2.5的一点有效措施有
用化学知识填空
(1)写出氯化铁的化学式并标出其中铁元素的化合价__________
(2)碳酸钠的化学式___________
(3)硫酸铜中的阳离子符号
(4)两个氮分子________
(5)三个铵根离子
(6)具有还原性的有毒气体的化学式_____________
(7)SO42-中“2”的含义是________________________
(8)金刚石和石墨性质不同的原因_________________
根据如图所示装置回答有关问题: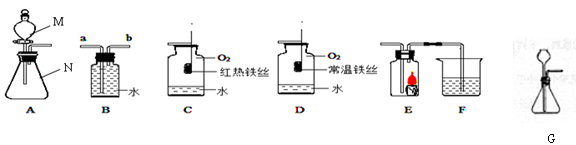
(1)写出下列仪器名称M;N
(2)若用装置B排水收集氧气,气体从(填“a”或“b”)导管通入瓶内;瓶底留少量水进行装置C中的实验,水的作用是.
(3)对比装置D和C,可以得出关于可燃物燃烧的条件是.
(4)某同学连接A、E、F进行实验,A中所加药品不同,F中所加药品相同.
①若实验时E中蜡烛熄灭,F中溶液变浑浊,说明A中产生的气体所具有的性质为.
②若实验时E中蜡烛燃烧更旺,F中溶液变浑浊,则A中反应的化学方程式为.
③F中溶液变浑浊的化学方程式为.
(5)某同学用碳酸钠粉末和稀盐酸反应来制取二氧化碳,为了较好地控制反应速率,
可选用的发生装置是(填字母A或G)。