(1)下列各组中,属于同分异构体的是______;肯定属于同系物的是______; (填编号)
① ②
② 
③ C3H6与C4H8 ④ CH3OH与C5H11OH
(2)下图是一种分子式为C3H6O2的有机物的红外光谱谱图,则该有机物的结构简式为:

(3)由苯和必要的试剂五步可合成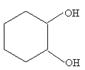 ,其过程如下:
,其过程如下: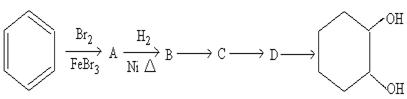
写出后四步反应的方程式:
①___________________________________________________;
②___________________________________________________;
③___________________________________________________;
④___________________________________________________。
I(1)在淀粉碘化钾溶液中通入少量氯气,立即会看到溶液变蓝色,反应的离子方程式是。
(2)在碘和淀粉形成的蓝色溶液中通入SO2气体,发现蓝色逐渐消失,反应的离子方程是。
(3)对比(1)和(2)实验所得的结果,将Cl 、I
、I SO2按还原性由强到弱顺序排列为。
SO2按还原性由强到弱顺序排列为。
II .(4) 除去铁粉中混有铝粉的试剂是,离子方程式为
(5) 1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是
甲、乙、丙三种物质之间有如下图所示的转化关系,其中甲物质为氧化物:
(1)若甲是不溶于水的白色固体,但既能溶于硫酸又能溶于氢氧化钠溶液, 写出下列转化的方程式:
乙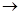 丙的离子方程式______________________; 丙
丙的离子方程式______________________; 丙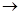 甲的化学方程式____________________。
甲的化学方程式____________________。
(2)若向乙溶液中加入KSCN溶液,混合溶液呈红色,则甲物质是________(填化学式)。 甲 乙的离子方程式是_____________________________。
乙的离子方程式是_____________________________。
A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。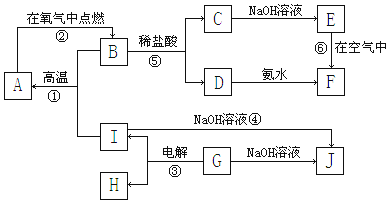
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置第周期、第族;
(2)写出反应①的化学方程式;
(3)写出反应④的离子方程式;
(4)写出反应③的电极方程式:
阳极:阴极:
(5)从能量变化的角度看,①②③反应中属于△H<0的反应是。(填序号)
豆类作物中含有的天然蛋白质在酶的作用下,水解生成A、B两种有机物。其中A的化学式为C4H7O4N,B的化学式为C6H14O2N2;已知A、B的分子结构中均不含甲基,且链端都有官能团。
(1)A的结构简式为:_______________________________________________________;
B的结构简式为:_________________________________________________________。
(2)题中酶的作用是_______________________________________________________;
影响其作用的主要因素有_________________________________________________。
合理膳食,保持营养均衡,合理使用药物是青少年学生健康成长的重要保证。
①维生素C能增强人体对疾病的抵抗能力,促进人体生长发育。在氯化铁溶液中加入维生素C溶液后,溶液由黄色转变为浅绿色,说明维生素C具有________性。
②________(填字母)具有止咳平喘作用,可用于治疗支气管哮喘、鼻粘膜充血引起的鼻塞等。
a.麻黄碱 b.阿司匹林 c.抗酸药 d.青霉素
③人们每天摄取的热能中大约有75%来自糖类,淀粉是一种重要的多糖,它在人体内水解的最终产物是________(填分子式)。碘元素是人体必需的微量元素之一,有“智力元素”之称,目前,我国通过在食盐中加入________(填化学式)从而达到补碘的效果。生物制药中往往涉及到活性蛋白质的提纯,可以采用的一种方法是________(填“过滤”、“高温蒸馏”或“盐析”)。淀粉、纤维素、油脂、蛋白质中不属于天然高分子的是________________。