某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
请回答下列问题:
(1) F中发生反应的化学方程式为 ;
(2)C中发生的反应为:8NH3 + 3Cl2=== N2 + 6NH4Cl ,其中氧化剂与还原剂的物质的量之比为 ;当a mol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗数常数为 mol-1(用含a、b的代数式表示);
(3) 将F制得的氯气通人含74g Ca(OH)2的石灰乳中,最多可制得漂白粉 g。
A、B、C、D、E、F六种元素的原子序数依次增大。A的最高正价和最低负价的绝对值相等。B的基态原子有3个不同的能级且各能级中电子数相等。D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍。请回答下列问题:
(1)F的基态原了价电子排布式为。
(2)B、C、D、E的原子的第一电离能由小到大的顺序为。(用元素符号回答)
(3)下列关于B2A2分子和A2D2分子的说法正确的是
A.分子中都含有σ键和π键
B.中心原子都sp杂化
C.都是含极性键和非极性键的非极性分子
D.互为等电子体
E.B2A2分子的沸点明显低于A2D2分子
(4)F2+能与BD分子形成[F(BD)4]2+,其原因是BD分子中含有。
(5)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示。B位于E和F原子紧密堆积所形成的空隙当中。与一个F原子距离最近的F原子的数目为,该晶体的化学式为。若该晶体的相对分子质量为M,阿伏加德罗常数为NA,B、E、F三种元素的原子半径分别为r1pm、r2pm、r3pm,,则该晶体的密度表达式为g·cm3。
随着不断向化工、石油、电力、海水淡化、建筑、日常生活用品等行业推广,钛金属日益被人们重视,被誉为“现代金属”和“战略金属”,是提高国防装备水平不可或缺的重要战略物资。工业主要以二氧化钛为原料冶炼金属钛。
Ⅰ.二氧化钛可由以下两种方法制备:
方法1:可用含有Fe2O3的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)制取,其主要流程如下:
(1)由滤液获得绿矾晶体的操作过程是。
(2)甲溶液中除含TiO2+之外还含有的金属阳离子有。
(3)已知10kg该钛铁矿中铁元素的质量分数为33.6%,能够得到绿矾晶体22.24kg,试计算最少加入铁粉的质量。
方法2:TiCl4水解生成TiO2·XH2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2,此方法制备得到的是纳米二氧化钛。
(4)①TiCl4水解生成TiO2·XH2O的化学方程式为。
②检验TiO2·XH2O中Cl-是否被除净的方法是。
Ⅱ.二氧化钛可用于制取钛单质
(5)TiO2制取单质Ti,涉及到的步骤如下:
反应②的化学方程式是,该反应成功需要的其他条件及原因是。
二甲醚(CH3OCH3)是一种重要的清洁燃料气,其储运、燃烧安全性、理论燃烧温度等性能指标均优于液化石油气,也可用作燃烧电池的燃料,具有很好的好展前景。
(1)已知H2、CO和CH3OCH3的燃烧热(ΔH)分别为-285.5kJ/mol、-283kJ/mol和-1460.0 kJ/mol,则工业上利用水煤气成分按1:1合成二甲醚的热化学方程式为。
(2)工业上采用电浮远凝聚法处理污水时,保持污水的pH在5.0,通过电解生成Fe(OH)3胶体,吸附不溶性杂质,同时利用阴极产生的H2,将悬浮物带到水面,利于除去。实验室以二甲醚燃料电池模拟该方法设计的装置如下图所示:
①乙装置以熔融碳酸盐为电解质,稀土金属材料为电极。写出该燃料电池的正极电极反应式;下列物质可用做电池熔融碳酸盐的是。
A.MgCO3 B.Na2CO3 C.NaHCO3 D.(NH4)2CO3
②写出甲装置中阳极产物离子生成Fe(OH)3沉淀的离子方程式:。
③已知常温下Kap[Fe(OH)3]=4.0×10—38,电解一段时间后,甲装置中c(Fe3+)=。
④已知:H2S的电离平衡常数:K1=9.1×10—8、K2=1.1×10—12;H2CO3的电离平衡常数:K1=4.31×10—7、K2=5.61×10—11。测得电极上转移电子为0.24mol时,将乙装置中生成的CO2通入200mL 0.2mol/L的Na2S溶液中,下列各项正确的是
A.发生反应的离子方程式为:CO2+S2—+H2O=CO32—+H2S
B.发生反应的离子方程式为:CO2+S2—+H2O=HCO3—+HS—
C.c(Na+)=2[c(H2S)+c(HS—)+c(S2—)]
D.c(Na+)+c(H+)=2c(CO32—)+2c(S2—)+c(OH—)
E.c(Na+)>c(HCO3—)>c(HS—)>c(OH—)
A~H均为短周期元素,A~F在元素周期表中的相对位置如图1所示,G与其它七种元素
| 图1 |
|||
| A |
B |
C |
|
| D |
E |
F |
|
| 图2 |
|||
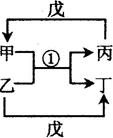 |
不在同一周期,H是短周期中原子半径最大的主族元素。由B、G构成的最简单化合物常为氮肥工业和纯碱工业的原料。由上述某些元素组成的物质甲~戊的转化关系如图2所示。请回答下列问题:
(1)已知图2中反应①是复分解反应,生成物中水已略去。
a.若戊是含有18电子的双原子分子,则甲的电子式为:_________。实验室制取气体丙的化学方程式为:___________________________。
b.若甲的水溶液呈碱性,丙的凝胶经干燥脱水后,常用做干燥剂,写出甲的一种用途。
c.若将a和b中甲的饱和溶液混合,会出现白色胶状沉淀,同时伴有刺激性气味的气体产生,则该反应的离子方程式: 。
(2)已知图2中反应①是置换反应,戊是单质,则戊可能是或,分别写出一个对应的反应①的化学方程式、。
短周期元素A、B、C、D、E、F六种元素,它们的原子序数由A到F依次增大。在周期表中,A的原子半径最小。B元素的原子最外层电子数是内层电子数的两倍,C为地壳中含量最多的元素,D是原子半径最大的短周期主族元素,D单质燃烧时呈现黄色火焰,D的单质在高温下与C的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物。D与F形成的离子化合物DF是常用的调味品。试根据以上叙述回答:
(1)元素名称:
A________、B________、C________、D________。
(2)E在元素周期表中的位置:_________________________________________________。
(3)F离子结构示意图:_____________________________________________________。
(4)A、B组成的最简单化合物的名称是____________________________________________。
(5)C、D按原子个数比1∶1组成的一种化合物与水发生反应的化学方程式为___________________________________________________________。
(6)能说明E的非金属性比F的非金属性____(填“强”或“弱”)的事实是________(举一例)。