为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100 mL稀H2SO4溶液;以0.14mol
/L的NaOH溶液滴定上述稀H2SO425.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14 mol/L NaOH溶液滴定硫酸的实验操作如下:
| A.用酸式滴定管取稀H2SO4 25.00 mL,注入锥形瓶中,加入指示剂。 |
| B.用待测定的溶液润洗酸式滴定管。 |
| C.用蒸馏水洗干净滴定管。 |
| D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3 cm处,再 |
把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E.检查滴定管是否漏水。
F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写): 。
②该滴定操作中应选用的指示剂是: 。
③在G操作中如何确定终点? 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) ,原因是 。
.[实验化学]
苯亚甲基苯乙酮俗称查尔酮,淡黄色棱状晶体,熔点58℃,沸点208℃(3.3kPa)易溶于醚、氯仿和苯,微溶于醇。制备原理如下: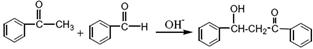
 (查尔酮)
(查尔酮)
(1)制备过程中,需在搅拌下滴加苯甲醛,并控制滴加速度使反应温度维持在25~30℃,说明该反应是(填放热或吸热)反应。如温度过高时,则可以采取措施。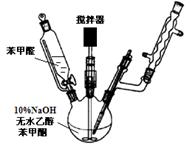
(2)产品结晶前,可以加入几粒成品的查尔酮,其作用是。
(3)结晶完全后,需抽滤收集产物。抽滤装置所包含的仪器除
减压系统外还有、(填仪器名称)。
(4)获得的深色粗产品加入活性炭,以95%乙醇重结晶。加入活性炭的作用是。
Fe2O3俗称氧化铁红,常用作油漆着色剂。工业以煤矸石(主要成分:SiO2 49.5%;Fe2O3 20.6%;Al2O318.9%,以及MgO、FeO等其他杂质)制备并研究氧化铁红的应用。
(一)制备氧化铁红
1.预处理:将煤矸石粉碎,在350℃下焙烧2小时。
2.加酸溶解:将预处理后的煤矸石溶于质量分数为15%过量的硫酸溶液中,过滤。在滤液中加入的H2O2。
3.调节pH:在上述滤液中加1mol/LNaOH溶液调节溶液的pH,再过滤,得到滤渣。
4.产品处理:将滤渣进行水洗、烘干、煅烧、研磨、过筛得产品。
已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
| 开始沉淀 |
1.3 |
3.3 |
7.5 |
10.3 |
| 完全沉淀 |
2.8 |
5.2 |
9.7 |
12.2 |
请回答下列问题:
(1)预处理时,将煤矸石焙烧2小时的目的是。
(2)酸浸操作中,过量H2SO4的作用是。
在实验室中进行该操作时,用到玻璃仪器有、。
(3)用NaOH溶液调节pH的最佳范围是。若从第二次过滤的滤液中获取较纯净的硫酸镁晶体,应补充的操作是、洗涤后,干燥即得。
(4)产品处理时,对滤渣水洗的操作是 。
(二)分析与讨论: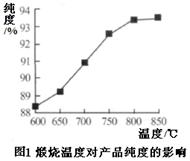
(5)产品处理时,煅烧温度对产品的纯度有很大影响。已知温度对产物纯度的影响如图1所示,则煅烧时温度最好控制在℃。
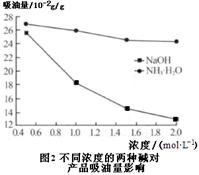
(6)吸油量是反映氧化铁红表面性质的重要指标。吸油量大,说明氧化铁红表面积较大,则用在油漆中会造成油漆假稠,影响质量。不同浓度的两种碱溶液对产物吸油量影响如图2所示,则上述生产中在调节溶液pH时,选用NaOH溶液而不选用氨水的原因是。
碱式碳酸镁[一般以xMgCO3•yMg(OH)2•zH2O表示]密度小,几乎不溶于水,但在水中引起轻微的碱性反应。不溶于乙醇,常温下不会分解,是橡胶制品的优良填料。工艺流程如下图: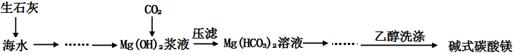
(1)回答下列问题:
①生石灰是以石灰石与焦炭混合煅烧生成,焦炭的作用是:。
②氢氧化镁浆液与CO2反应的化学方程式为:
。
③碱式碳酸镁用乙醇洗涤的目的是:。
(2)已知:碱式碳酸镁分解反应方程式为:
xMgCO3•yMg(OH)2•zH2O 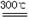 (x+y)MgO+xCO2↑+(y+z)H2O
(x+y)MgO+xCO2↑+(y+z)H2O
某同学将46.6g碱式碳酸镁样品置于硬质玻璃管中充分灼烧至恒重,残留固体质量为20.0g,将产生的气体先通过足量的浓硫酸,再通过足量的碱石灰,碱石灰质量增重17.6g。根据实验测定的数据,确定碱式碳酸镁[xMgCO3·yMg(OH)2•zH2O]的化学式(要求写出计算过程)。
(本题16分)Ⅰ.实验室经常要制取某种气体并验证该气体的性质。
(1)下列装置适合作尾气吸收的是(填序号)。
(2)向下列装置中通入气体X,A中品红溶液褪色,则X可能是___________(至少填两种)如果要证明X是SO2气体,接下来的操作是:________________________________
Ⅱ.实验室用FeSO4溶液和NaOH溶液反应制取Fe(OH)2,却很难看到稳定的白色沉淀。有同学设计了一种新的实验方法,能清楚看到生成白色沉淀及白色沉淀转化成红褐色沉淀的现象。请完成以下空白:
(1)取一定体积的0.1mol.L-1NaOH溶液放于烧杯中,_________后,再滴入几滴植物油;
(2)选择装置___________(填“甲”或“乙”),将(1)所得溶液加入到装置中并按图示组装好装置。
(3)在你选择的装置上标明电极材料分别为____________、________________
(4)实验中可在___________看到稳定的白色Fe(OH)2沉淀。
(5)如果要看到白色沉淀转化为红褐色沉淀的的现象,接下来的操作是______________
(本题16分)Ⅰ。某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验。
【实验1】铜与浓硫酸反应,实验装置如图所示。
实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面。
(1)装置A中发生反应的化学方程式为。
(2)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是。
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是。
Ⅱ。饱和的NaHSO3溶液可以与醛发生加成反应,生成水溶性的α-羟基磺酸钠。发生的反应为:
R-CHO + NaHSO3 R-CH(OH)SO3Na
R-CH(OH)SO3Na
反应是可逆的,在通常条件下有70%--90%向正反应方向转化。
(4)利用Ⅰ中装置制取少量NaHSO3溶液,应采取措施,将装置进行部分改变。这种措施是:_____________________________________________________________________;确认有NaHSO3生成的现象是:_______________________________________.
(5)若溴苯中混有杂质乙醛,欲将此杂质除去,可采用的试剂是:__________,其分离的方法是:_____________________.
(6)若在CH3-CH(OH)SO3Na 水溶液中加入足量盐酸,有机物转化为:___________,将该转化产物分离出来的方法常用__________________.