实验室常用甲酸和浓硫酸共热制取CO,其反应如下,HCOOH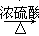 CO↑+H2O。
CO↑+H2O。
回答下列问题:
(1)其发生装置与下列气体的发生装置相同的是________。
A.NH3 B.CO2
C.Cl2 D.C2H2
(2)其收集方法与下列气体的收集方法相同的是________。
A.Cl2 B.SO2
C.NO2 D.NO
(3)从下列仪器中,选出最合适的,组装制取、净化和收集CO的装置,其中不需要的是________。
A.铁架台 B.圆底烧瓶 C.分液漏斗 D.长颈漏斗
E.玻璃导管 F.洗气瓶 G.水槽 H.双孔塞 I.酒精灯
J.石棉网
(4)尾气如何处理?________________________________________________________________________。
已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去)。
请回答下列问题:
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是;工业上制取A的离子方程式。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为。
(3)若D是氯碱工业的主要产品之一,B有两性,则反应②的离子方程式是。
(4)若A、C、D都是常见气体,C是导致酸雨的主要气体,则反应③的化学方程式为。
某同学将搜集到的一定量的酸雨保存在密闭容器中,每隔一定时间测酸雨的pH,发现在起始一段时间内,酸雨的pH呈减小趋势,用离子方程式解释原因:。
氨气是一种重要的工业产品,也是一种重要的化工原料。为研究氨气的制备及性质,某学习小组进行了下面的探究活动:
(1)实验室中往往采用熟石灰与氯化铵制备氨气,写出该反应的化学方程式(注明反应条件)。
(2)实验室中还可以采用如图1装置(略去了夹持装置)和药品快速制备氨气:
①甲同学不明白该方法中制备氨气的原理,于是学习小组内成员展开了讨论,得出了下面的结论,其中不正确的是(填字母序号)。
a.氨水中的NH3·H2O分解
b.氨水中存在可逆反应:NH3·H2O 
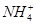 +OH-,NaOH晶体使该可逆反应的平衡向左移动
+OH-,NaOH晶体使该可逆反应的平衡向左移动
c.反应原理与铵盐、熟石灰制备氨气的反应原理相同
d.NaOH溶于水放出热量,使NH3·H2O分解
②乙同学取质量分数为34%的0.89 g·mL-1的浓氨水10 mL,用过量的NaOH与之混合,然后用500 mL的烧瓶收集氨气。请你计算最多可收集满标准状况下的氨气个烧瓶。
(3)丙同学进行氨气的喷泉实验探究。
①收集氨气时需要用干燥剂干燥,如图2,装置B中盛装的干燥剂是。
②该同学利用图3装置,成功地完成了喷泉实验。请你简要地写出该同学操作的正确方法:。
反应A(g)  B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题: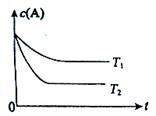
(1)上述反应的温度T1T2,平衡常数K(T1)K(T2)。(填“大于”、“小于”或“等于”)
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为。
②反应的平衡常数K=。
③反应在0~5min区间的平均反应速率v(A)=。
海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:
(1)请列举海水淡化的两种方法:________、________。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、________、________或H2、________。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为_____________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是____________。
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:
请你参与分析讨论:
①图中仪器B的名称:________。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是___________。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:____。
④C中液体产物颜色为________。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是________。
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)= N2O4(1)△H1= -195kJ·mol-1
②N2H4(1) + O2(g)= N2(g) + 2H2O△H2= -534.2kJ·mol-1
写出肼和N2H4反应的热化学方程式;
(3)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为。