下表是元素周期表的一部分。根据表中的10种元素,用元素符号或化学式填空:
| 族 期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
① |
|
|
|
|
|
|
|
| 2 |
|
|
|
② |
|
③ |
|
|
| 3 |
|
|
④ |
⑤ |
|
⑥ |
⑦ |
⑧ |
| 4 |
⑨ |
|
|
|
|
|
⑩ |
|
(1)在①~⑩元素中,金属性最强的金属元素是________。
(2) 在①~⑩元素中,________(填化学式)的单质既可以和盐酸又可以和氢氧化钠溶液反应,其单质与氢氧化钠溶液反应的化学方程式是_______________________。
(3)在①~⑩元素中,形成的最高价氧化物的水化物的酸性最强的酸的分子式是________。
(4)④、⑥、⑦、⑨所形成的单核离子中,半径最大的离子是________。
(5)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________。a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(6)用电子式表示元素⑦与元素⑨形成的化合物的形成过程: 。
用电子式表示元素⑥与元素①形成的化合物的形成过程: 。
(7)①与③和①与⑥均能形成18个电子的化合物,此两种化合物发生反应的化学方程式为 。
(8)比较⑩与⑦单质氧化性的强弱的反应的化学方程式是
比较②与⑥单质的非金属性的强弱的反应的化学方程式是
提纯下表所列物质(括号内为少量杂质),在B中选择加入试剂,在C中选择操作的方法。填表(填入序号):
B:(1)NaCl细颗粒;(2)NaOH溶液;
(3)水;(4)CaO;(5)饱和Na2CO3;
(6)溴水;(7)KMnO4溶液。
C:(a)变性;(b)盐析;(c)蒸馏;
(d)分液;(e)结晶;(f)洗气。
| 物质 |
加入试剂 |
操作方法 |
| ①苯(苯甲酸) |
||
| ②乙烷(乙烯) |
||
| ③肥皂(甘油) |
||
| ④乙醇(水) |
||
| ⑤乙酸乙酯(乙酸) |
(9分) 右图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题: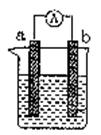
(1)当电极a为Al、电极b为Cu、电解质溶液为稀硫酸时,正极的电极反应式为:
(2)当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该装置(填“能”或“不能”)形成原电池,若不能,请说明理由,若能,请指出正、负极
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,采用酸性溶液为电解液;则氢气应通入极(填a或b,下同),电子从极流出。a极发生电极反应式为:_________________________
A是一种重要的化工原料,其产量可以用来衡量一个国家的石油化工水平,D是一种酸性物质,E是具有果香气味的烃的衍生物。A、B、C、D在一定条件下存在如下转化关系(石蜡油含17个碳原子以上的液态烷烃,部分反应条件、产物被省略)。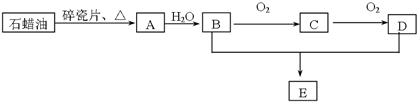
(1)工业上,由石油获得汽油、煤油、石蜡油等成份的方法是,
(2)写出A、B的结构简式;
(3)A→B的反应类型是;
B+D→E的反应类型是反应方程式为:
(4)实验室常用如图所示装置制取D,请在下图所示方框中补充画出有关仪器,并标明所盛药品的名称。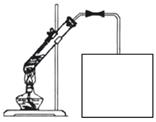
(8分)某有机物的结构简式为HO-CH2—CH=CH—CH=CH-CHO。
(1)请你写出下列官能团
“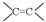 ”、“HO-”、“-CHO”的名称: 、 、。
”、“HO-”、“-CHO”的名称: 、 、。
(2)验证该有机物中含有“-CHO”,常采用的试剂是 ,产生的现象为 。
(3)该有机物的性质描述正确的有
| A.与金属Na反应放出O2 | B.能与新制Cu(OH)2反应,产生红色沉淀 |
| C.不能发生银镜反应 | D.一定条件下能与H2发生加成反应 |
(4)1mol该有机物完全与溴水发生加成反应时,需要Br2mol
(9分)现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
能形成双原子分子,原子间存在3对共用电子对 |
| X |
M层有3个电子 |
| Y |
最外层电子数是最内层电子数2倍,其最高价氧化物是一种固体,用于生产光导纤维 |
| Z |
最低负价为—2价,且无最高正价 |
用化学符号回答以下问题:
(1)比较:氢化物的稳定性:TZ,最高价氧化物对应水化物的酸性:TY。(填“>”、“<”或“=”)
(2)Y元素位于元素周期表中第周期,第族。
请你设计一实验方案,证明X的氯化物是离子化合物还是共价化合物。简要写出实验内容、现象和结论。。
(3)X的最高价氧化物对应水化物与烧碱反应的离子方程式为:。
(4)T、X、Y、Z四种原子的半径由大到小的顺序为:。