2013年初,雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为: 。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如右图所示。
。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如右图所示。 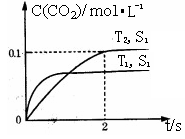
据此判断:
①该反应的△H 0(填“>”、“<”)。
②在T2温度下,0~2s内的平均反应速率v(N2)= 。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
④若该反应在恒容的密闭体系中进行,下列示意图正确且能说明该反应进行到t1时刻达到平衡状态的是 (填代号) 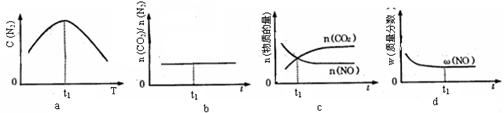
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
例如: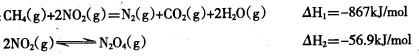
写出CH4 (g)催化还原N2O4(g)生成N2 (g)和H2O (g)的热化学方程式 。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。右图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为 。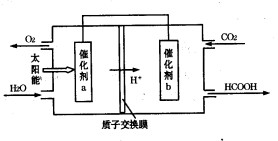
某有机化合物A的结构简式如图回答下列问题:
(1)A在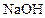 水溶液中加热得到B和C,C 是芳香族化合物,则C的结构简式是。
水溶液中加热得到B和C,C 是芳香族化合物,则C的结构简式是。
(2)C酸化后可得F,F不能发生的反应类型是(填写字母代号)。
a.取代反应 b.加成反应 c.消去反应
d.加聚反应 e.氧化反应 f.还原反应
(3)B与足量的某饱和一元羧酸D充分反应后生
成E,E和B的相对分子质量之差为84,则D的摩尔质量为。
(4)F可以发生如下转化,且G与H互为同分异构体。
请写出:①H的结构简式。②由F生成G的化学方程式。
(5)符合下列三个条件的F的同分异构体的数目有多种,任写出其中一种的结构简式。
①含有邻二取代苯环结构②与F具有相同的官能团③不与 溶液发生显反应
溶液发生显反应
具有水果香味的中性物质A可以发生下列变化: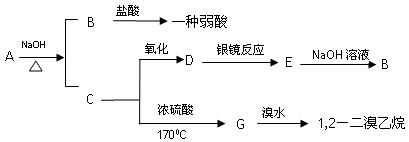
(1)推断下述物质的名称
A ___________、B _________。
(2)写出下列变化的化学方程式:
A与NaOH溶液反应 ___________________________________________ ;
D的银镜反应 _________________________________________________ 。
已知反应①、②是化工生产中的两个重要反应:
①
②乙为硫铁矿(主要成分FeS2)经过粉碎后在沸腾炉中燃烧得到D和E(该反应为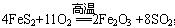 ;△H<0)。其中,A、D在常温常压下为刺激性气味气体,C为无色无味气体。请回答:
;△H<0)。其中,A、D在常温常压下为刺激性气味气体,C为无色无味气体。请回答:
(1)A的电子式是。
(2)将A通入B的溶液中,反应的离子方程式是。
(3)1 g C在A中燃烧时放出92.3 kJ的热量,该反应的热化学方程式是。
(4)工业上可利用E为原料冶炼其中所含的金属,方法是。
(5)将A和D按物质的量1:1通入下列装置中:
该过程中的化学方程式是。
上述实验装置设计不完整,请将所缺部分在装置图的右边方框中画出。
(6)一定条件下,将12 g乙放入过量的的浓硝酸中,反应过程中转移1.5 mol电子,该反应的离子方程式是。
有A、B、C、D、E五种短周期主族元素,原子序数按A、B、C、D、E顺序增大,A是半径最小的原子,B最外层电子数是次外层电子数的2倍,C2-与E+最外层电子数均为次外层的4倍,E和B 同主族。
(1)A、C、D三种元素形成的化合物的电子式_____________.
(2)BC2的电子式_____________.属_____________分子(填分子极性)。
EC2其固体属____________晶体。
(3)用电子式表示D2 C的形成过程_____________.
(4)B、C、D、E单质熔点由高到低的顺序为____________(填单质化学式)
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Ag+ Na+ |
| 阴离子 |
NO3- SO42- Cl- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、 B、 C三种溶液,电极均为石墨电极。
接通电源,经过一段时间后,测得乙中C电极质量增加了27克。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
(1)M为电源的_______极(填写“正”或“负”),甲、乙电解质分别为_______、_______(填写化学式)。
(2)计算电极f上生成的气体在标准状况下的体积_____________。
(3)写出乙烧杯的电解池总反应_____________________________。
(4)若电解后甲溶液的体积为25L,则该溶液的pH为___________ 。
(5)要使丙恢复到原来的状态,应加入g 。(填写化学式)