某二氧化锰样品中含有杂质炭,为测定该样品中二氧化锰的质量分数,某兴趣小组设计了如下实验方案:在一定量的样品中通入干燥纯净的氧气,使杂质炭在加热条件下反应生成CO2来进行分析测定。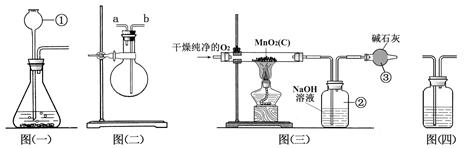
(1)仪器①的名称是 。如果该实验选择图(一)装置来制取氧气,该反应的化学方程式为 。
(2)用图(二)装置可用于干燥氧气:应在烧瓶内装入_________进行干燥气体,气体应从________ 端通入。
(3)图(三)是用干燥纯净的O2与样品反应来测定二氧化锰质量分数的装置,装置③中装有碱石灰(生石灰与固体氢氧化钠的混合物),其作用是_________________________________________。
(4)为验证图(三)中装置②已将CO2吸收完全,可在装置②与③之间加入图(四)装置进行证明,则图(四)装置中加入的试剂为____________(填字母)。
A.NaOH溶液 B. 澄清石灰水 C. 浓硫酸
(5)称取5.0 g二氧化锰样品进行实验,图(三)中装置②反应前后的质量差为1.1 g,则样品中二氧化锰的质量分数为____________(填计算结果)。
小炜在家中利用实验的方法探究了木片和木炭燃烧的现象,你认为它们燃烧会有哪些不同的现象?(让我们也动手做一做吧)
下表是空气中的气体成分和人体呼出的气体成分含量对照表
| 气体成分 |
氮气 |
氧气 |
二氧化碳 |
水 |
其他气体 |
| 空气中的气体(%) |
78 |
21 |
0.03 |
0.07 |
0.9 |
| 呼出的气体(%) |
78 |
16 |
4 |
1.1 |
0.9 |
某校研究性学习小组的同学设计了简单的实验方案,验证呼出的气体与吸入空气成分的含量有什么不同,其主要操作步骤如图1-4所示。

图1-4
请依据图示将主要实验操作步骤及验证依据填入下表中:
| 实验步骤 |
验证依据 |
| 1. |
|
| 2. |
根据__________________________判断CO2含量不同 |
| 3. |
根据__________________________判断O2含量不同 |
| 4. |
根据__________________________判断含水量不同 |
某同学对蜡烛(主要成分是石蜡)及其燃烧进行了如下探究。请填写下列空格:
(1)取一枝蜡烛,用小刀切下一小块,把它放入水中,蜡烛浮在水面上。结论:石蜡的密度比水_________。
(2)点燃蜡烛,观察到蜡烛火焰分为_________、_________、_________三层。把一根火柴梗放在蜡烛的火焰中(如图1-3)约1 s后取出可以看到火柴梗的_________处最先炭化。结论:蜡烛火焰的_________温度最高。
图1-3
(3)再将一只干燥的烧杯罩在蜡烛火焰上方,烧杯内壁出现。取下烧杯,迅速向烧杯内倒入少量澄清石灰水,振荡,澄清石灰水变_________。结论:蜡烛燃烧时生成了_________。
某兴趣小组在探究CO2与NaOH溶液反应的实验中,先用铝制易拉罐收集满一罐CO2气体,然后迅速向其中加入一定量的NaOH浓溶液,立即将易拉罐口封闭(不漏气),轻轻摇动易拉罐,发现易拉罐很快变瘪,但过一段时间后,易拉罐又重新鼓起来(反应过程中温度的变化忽略不计)。
【讨论】甲同学认为易拉罐变瘪,说明CO2与NaOH溶液发生反应,CO2与NaOH反应的化学方程式是;乙同学认为此结论不合理,原因是,还需进一步验证,验证方法是。
【提出问题】易拉罐为什么又后鼓起来?是不是反应又产生了气体,该气体的成分是什么?
【猜想假设】a.该气体可能是CO2b.该气体可能是。
【查阅资料】①Na2CO3具有较强的热稳定性,只有在高温条件下才会分解;
②铝不仅与酸反应,还能与碱溶液反应2Al+2NaOH+2H2O==2NaAlO2+3X↑
【实验验证】
①将易拉罐口打开,迅速用燃着的木条伸入罐口,发出“噗”的一声,产生淡蓝色火焰,片刻后熄灭,反应的化学方程式是;。
②取少量铝片于试管中,先加入适量的水,无明显变化。片刻后再加入少量的氢氧化钠浓溶液,产生气泡。该步实验的目的是;
【结论】证明猜想成立;
【反思与应用】在生活中铝制容器不能用来盛装酸性物质,也不能盛装物质。
已知2Al+Fe2O3=== 2Fe+Al2O3在化学上被称为“铝热反应”,人们可利用该反应来焊接铁轨。从反应中可以看出Al比Fe活泼,镁和氧化铜也能发生类似的反应。该反应的化学方程式为。某活动小组在实验室中进行镁和氧化铜的反应,充分反应之后,大家对于反应后的固体剩余物产生了疑问,请你帮助他们完成探究实验。
【提出问题】反应后的固体剩余物是什么?
【做出假设】甲组同学经过讨论一致认为:反应后的固体剩余物中一定含有。对于可能含有的物质他们做出了如下假设:乙组同学认为可能含;丙组同学认为可能含。
【实验探究】经过查阅资料、回忆已学过的知识,大家决定设计如下的实验对反应后的固体剩余物进行探究。
| 实验操作 |
实验现象 |
实验结论 |
| ①取少量反应后的固体剩余物于试管中,向其中加入足量的。 |
固体部分溶解,溶液为无色。 |
甲组同学的结论正确。 |
| ②另取少量固体于试管中,进行与实验①一样的操作。 |
乙组同学的假设成立。 |
|
| ③另取少量固体于试管中,进行与实验①一样的操作。 |
丙组同学的假设成立。 |
【反思与拓展】对于有多种物质参加的化学反应,要判断充分反应后得到的剩余物的成分,需要考虑到。由此联想到:在盐酸和氢氧化钠溶液发生的中和反应后的剩余溶液中滴入无色酚酞试液,若酚酞试液不变红,则反应恰好完全反应(填“一定”或“不一定”)。