下列有关氧化还原反应的说法正确的是
| A.浓盐酸在化学反应中既可以做氧化剂,又可以作还原剂 |
| B.工业上常以SiO2为原料制取粗硅,这一过程中,硅元素被氧化 |
| C.在任何条件下都不能发生反应:Cu + H2SO4=CuSO4+ H2↑ |
| D.亚氯酸可发生分解反应:HClO2 → ClO2↑ + Cl2+ H2O(未配平),1 mol HClO2分解时,转移电子的物质的量为1 mol |
固体NH5属于离子晶体。它与水反应的化学方程式为:NH5+H2O→NH3·H2O+H2↑,它也能跟乙醇发生类似的反应,并都产生氢气。下列有关NH5叙述正确的是
| A.与水反应时,水作氧化剂 | B.NH5中N元素的化合价为+5价 |
| C.1 mol NH5中含有5NA个N—H键 | D.与乙醇反应时,NH5被还原 |
尿黑酸症是由酪氨酸在人体内非正常代谢而产生的一种疾病。其转化过程如下:
下列说法错误的是
| A.1mol酪氨酸能与含1molHCl的盐酸反应,又能与含2molNaOH的溶液反应 |
| B.酪氨酸能发生加成、取代、消去和缩聚反应 |
| C.1mol对羟苯丙酮酸最多可与4molH2反应 |
| D.1mol尿黑酸最多可与含3molBr2的溶液反应 |
重氧(18O)是氧元素的一种放射性同位素,下列说法正确的是
| A.Na2O2与H218O反应时生成18O2气体 |
B.向2SO2(g)+O2(g) 2SO3(g)的平衡体系中加入18O2,结果18O只出现在SO3中 2SO3(g)的平衡体系中加入18O2,结果18O只出现在SO3中 |
| C.CH3COOH和CH3CH218OH发生酯化反应时,产物水的分子式为H218O |
| D.用惰性电极电解含有H218O的水时,阳极会产生三种相对分子质量不同的氧分子 |
早在1807年化学家戴维用电解熔融氢氧化钠制得钠: 4NaOH(熔)  4Na + O2↑+ 2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠:
4Na + O2↑+ 2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠: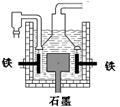
3Fe+4NaOH Fe3O4+2H2↑十4Na↑。下列有关说法正确的是
Fe3O4+2H2↑十4Na↑。下列有关说法正确的是
| A.电解熔融氢氧化钠制钠,阳极发生电极反应为:2OH--2e→H2↑+O2↑ |
| B.盖·吕萨克法制钠原理是利用铁的还原性比钠强 |
| C.若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数相同 |
| D.目前工业上常用电解熔融氯化钠法制钠(如上图),电解槽中石墨极为阳极,铁为阴极 |
臭氧层是地球上生物的保护层,在平流层存在:2O3 3O2;O3
3O2;O3 O+ O2。某些微粒X(X为Cl、Br等) 能加速O3的分解:X+O3→XO+ O2; XO+O→X + O2。已知: 2O3
O+ O2。某些微粒X(X为Cl、Br等) 能加速O3的分解:X+O3→XO+ O2; XO+O→X + O2。已知: 2O3 3O2 +144.8 kJ ; t ℃时K=3×1076。下列说法错误的是
3O2 +144.8 kJ ; t ℃时K=3×1076。下列说法错误的是
| A.氟利昂释放出的氯原子是臭氧层中促进O3分解的催化剂 |
| B.高压放电条件下O2可以转化成O3 |
| C.O3转变为O2时的能量变化可用右图表示 |
D.t ℃时3O2 2O3 K≈3.33×10-77 2O3 K≈3.33×10-77 |