实验室欲用NaNO3固体配制80 mL 1.4 mol·L-1的NaNO3溶液,试回答:
(1)用不到的仪器是__________;
A.烧杯 B.500 mL容量瓶 C.量筒
D.胶头滴管 E.玻璃棒 F.100 mL容量瓶
(2)配制时应称取NaNO3__________g;
(3)实验开始时,需检查容量瓶__________;
(4)在配制一定物质的量浓度溶液的实验中,下列操作对所配溶液浓度无影响的是(写字母) __________;会使所配溶液浓度偏大的是__________;会使所配溶液浓度偏小的是__________。
A.在烧杯中溶解溶质,搅拌时不慎溅出少量溶液
B.未将洗涤烧杯内壁的溶液转移入容量瓶
C.容量瓶中所配的溶液液面未到刻度线便停止加水
D.将配得的溶液从容量瓶转移到干燥、洁净的试剂瓶中时,有少量溅出
E.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
F.容量瓶中液面将达到刻度线时,俯视刻度线和液面
合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g) 2NH3(g)ΔH=-92.4 kJ·mol-1
2NH3(g)ΔH=-92.4 kJ·mol-1
一种工业合成氨的简易流程图如下:
(1)在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)当反应达到平衡时,N2和H2的浓度比是。升高平衡体系的温度(保持体积不变), 混合气体的平均相对分子质量。(填“变大”“变小”或“不变”)
2NH3(g)(正反应为放热反应)当反应达到平衡时,N2和H2的浓度比是。升高平衡体系的温度(保持体积不变), 混合气体的平均相对分子质量。(填“变大”“变小”或“不变”)
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___________________________。
(3)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)  CO(g)+3H2(g)ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g)ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)  CO2(g)+H2(g)ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g)ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是_____。
a.升高温度 b.增大水蒸气浓度
c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若a mol CO和H2的混合气体(H2的体积分数为80%)与H2O反应,得到1.14a mol CO、CO2和H2的混合气体,则CO转化率为_____________。上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)__________。简述本流程中提高合成氨原料总转化率的方法:_____________________________________。
汽车尾气里含有的NO气体是由内燃机燃烧时产生的高温引起氮气和氧气反应所致: N2(g)+O2(g) 2NO(g)ΔH>0。已知该反应在2404℃时,平衡常数K=6.4×10-3。
2NO(g)ΔH>0。已知该反应在2404℃时,平衡常数K=6.4×10-3。
请回答下列问题。
(1)该反应的平衡常数表达式为____________________________________。
(2)该温度下,向2 L密闭容器中充入N2和O2各1mol,平衡时,N2的转化率是________%(保留整数)。
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol/L、4.0×10-2 mol/L和3.0×10-3 mol/L,此时反应________(填“处于化学平衡状态”、“向正方向进行”或“向逆方向进行”),理由是_____________________。
(4)将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是________。
向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数_______(填“变大”、“变小”或“不变”)。
工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下:
(1)已知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式:_____。当温度降低时,化学平衡常数K值________(填“增大”“减小”或“无影响”)。
(2)氨气是制取硝酸的重要原料,合成氨反应的化学方程式如下:N2+3H2 2NH3,该反应在固定容积的密闭容器中进行。
2NH3,该反应在固定容积的密闭容器中进行。
①下列各项标志着该反应达到化学平衡状态的是________(填字母)。
| A.容器内N2、H2、NH3的浓度之比为1∶3∶2 |
| B.v正(N2)=v逆(H2) |
| C.容器内压强保持不变 |
| D.混合气体的密度保持不变 |
②若在恒温条件下,将N2与H2按一定比例混合通入一个容积为2 L固定容积的密闭容器中,5 min后反应达平衡时,n(N2)=1.0 mol,n(H2)=0.8 mol,n(NH3)=0.8 mol,则反应速率v(H2) =_____,平衡常数=________。
③若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将(填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度(填“大于”“小于”或“等于”)原来的2倍。
( 12分)2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示,已知1 mol SO2(g) 被氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
2SO3(g)反应过程的能量变化如图所示,已知1 mol SO2(g) 被氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。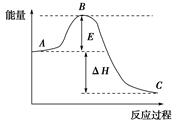
回答下列问题:
(1)E的大小对该反应的反应热有无影响?。
(2)该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?,理由是_________。
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自己被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:。
(4)已知单质硫的燃烧热为296 kJ/mol,写出S(s)与O2生成 SO3(g)的热化学方程式:。
下表为元素周期表的一部分,列出了7种元素在元素周期表中的位置:
| 族 周 期 |
ⅠA |
0 |
|||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
||
| 2 |
② |
③ |
④ |
||||||
| 3 |
⑤ |
⑥ |
⑦ |
请按要求回答下列问题(用化学用语回答):
(1)写出④的单核离子结构示意图:,③与①所形成的化合物的结构式为:。
(2)7种元素中,原子半径最小的是:(填元素符号)。
(3)用电子式表示元素②与④最高价化合物的形成过程:。
(4)元素⑤和元素⑥最高价氧化物的水化物相互反应的化学方程式为:。
(5)元素④的氢化物与元素⑦的单质反应的离子方程式为:。