实验室中常用中和滴定、氧化还原滴定等方法测定未知浓度的某反应物的物质的量浓度或测定某样品的浓度。
(1)用已知物质的量浓度的盐酸滴定未知物质的量浓度的NaOH溶液,下列操作会导致测定结果偏高的是________。
| A.用标准的盐酸润洗酸式滴定管2~3次 |
| B.用待测碱液润洗碱式滴定管2~3次 |
| C.用待测碱液润洗锥形瓶2~3次 |
| D.用蒸馏水润洗锥形瓶2~3次 |
(2)请回答下列关于指示剂的选用问题:
①用一定浓度的盐酸滴定未知浓度的NaOH溶液时,应选择________做指示剂。
②用已知浓度的盐酸滴定未知浓度的Na2CO3溶液且最终生成二氧化碳时,应选择________做指示剂。
③用已知浓度的Na2S2O3溶液滴定未知浓度的碘水时,应选择________做指示剂(有关反应的化学方程式为2Na2S2O3+I2===Na2S4O6+2NaI)。
④用已知浓度的KMnO4溶液滴定未知浓度的硫酸亚铁酸性溶液时是否应选择指示剂________(填“是”或“否”)。原因是
________________________________________________________________________
________________________________________________________________________。
下表列出了周期表短周期中6种元素的有关数据:
| 元素编号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
| 原子半径(nm) |
0.075 |
0.110 |
0.152 |
0.071 |
0.186 |
0.099 |
| 最高价态 |
+5 |
+5 |
+1 |
0 |
+1 |
+7 |
| 最低价态 |
﹣3 |
﹣3 |
0 |
﹣1 |
0 |
﹣1 |
根据上表信息填空:
(1)写出下列编号对应元素的元素符号:②,③.
(2)元素④在周期表中的位置是.
(3)元素⑤形成的两种常见氧化物的化学式分别为、,其中都含有的化学键是.
(4)①的氢化物和⑥的氢化物反应的化学方程式为.
(一)实验方法测定反应热---------中和热测定
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol· L-1盐酸、0.55mol· L-1NaOH溶液,尚缺少的实验玻璃用品是、。
(2)他们记录的实验数据如下:
| 实 验 用 品 |
溶 液 温 度 |
中和热△H |
|||
| t1 |
t2 |
||||
| ① |
50mL0.55mol.L-1NaOH |
50mL.0.5mol.L-1HCl |
20℃ |
23.3℃ |
|
| ② |
50mL0.55mol.L-1NaOH |
50mL.0.5mol.L-1HCl |
20℃ |
23.5℃ |
已知:Q=Cm(t2 -t1),反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各物质的密度均为1g·cm-3。
计算完成上表。△H=
(3)某研究小组将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。回答下列问题:
研究小组做该实验时环境温度(填“高于”、“低于”或“等于”)22 ℃,此反应所用NaOH溶液的浓度应为mol/L。
(二)通过化学计算间接获得
(1)已知拆开1mol的H—H键、I—I、H—I键分别需要吸收的能量为436kJ、153kJ、299kJ。
则反应H2(g)+I2(g)=2HI(g)的反应热△H=kJ·mol-1
(2)已知:2H2(g)+ O2(g) = 2H2O (l) △H=-571.6 kJ·mol-1
H2(g)+1/2O2(g) = H2O(g) △H=-241.8 kJ·mol-1
根据上述反应确定:H2燃烧热为kJ·mol-1;
现有稀硫酸和稀硝酸的混合溶液,已知其中稀硫酸的浓度为4mol/L,稀硝酸的浓度为2 mol/L。取10mL混合酸,向其中加入过量铁粉,反应结束后,在标准状况下可收集到的气体成分为、;体积分别是L、L。(假设HNO3只被还原为NO)
A~F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示。
| 元素 |
原子结构或性质 |
| A |
原子最外层电子数是内层电子总数的1/5 |
| B |
形成化合物种类最多的元素,其单质为固体 |
| C |
生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D |
地壳中含量最多的元素 |
| E |
与D同主族 |
| F |
与E同周期,且最外层电子数等于电子层数 |
请回答下列问题:(用对应的化学用语回答)
(1)B在元素周期表中的位置是__________;用电子式表示A和E形成的化合物的形成过程。
(2)A、 D 、E、 F离子半径由大到小的顺序为________________________________。
(3)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是__________________;
(4)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是____________________。该反应为反应。(填“吸热”或“放热”)
(5)F的最高价氧化物与E的最高价氧化物的水化物反应的离子方程式为。
(6)如图:将A和F的单质与烧碱液构成原电池,负极的电极反应式为;外电路中电子从电极流向电极 。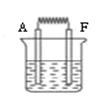
某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断。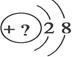
(1)该微粒是中性微粒,这种微粒的元素符号是____________;
(2)该微粒的符号为X3-,则这种微粒的单质的电子式为___________;
(3)该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,该单质与水反应的化学方程式___________________________________;
(4)该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,该单质与水反应的离子方程式:________________________________;
(5)该微粒的还原性很弱,失去2个电子后变成原子,其氢化物的结构式:__________;
(6)该微粒的符号为X3+,其氢氧化物与强碱反应的离子方程式:______________________.