在现代生活中,人们越来越注意微量元素的摄入。碘元素对人体健康有着至关重要的作用。为预防碘缺乏病,我国卫生部规定每千克食盐中应含有40~50 mg KIO3。下表是某超市出售的加碘精制盐的有关说明:
| 产品标准 |
GB5461-2000 |
| 配料表 |
氯化钠、碘酸钾、抗结剂 |
| 氯化钠含量 |
≥98.5% |
| 含碘量(以I计) |
20~50 mg/kg |
| 储藏方法 |
密闭、避光、防潮 |
| 食用方法 |
待食品熟后加入 |
| 包装日期 |
见打印批号 |
某同学设计实验验证此食盐中是否含碘和检查该食盐是否为合格产品。
(1)完成下列实验报告:
| 实验步骤 |
实验现象 |
实验结论(步骤2用离子方程式表示) |
| 1.取食盐少许置于一支试管中,加入适量的蒸馏水,振荡 |
固体完全溶解 |
食盐及碘酸钾都能溶于水 |
| 2.向上述溶液滴加适量的亚硫酸氢钠溶液,振荡 |
溶液出现棕黄色 |
|
| 3.再向上述溶液中滴加淀粉溶液,振荡 |
溶液变成蓝色 |
|
(2)加碘食盐的包装袋上标有食用方法:待食品熟后加入。其原因是
________________________________________________________________________。
(3)该同学取该食盐样品100.0 g完全溶解于水中,然后加入用盐酸酸化的淀粉KI溶液,结果溶液呈蓝色,则反应的离子方程式为
________________________________________________________________________。
为进一步确证样品是否为合格产品,该同学又用0.010 mol·L-1的Na2S2O3溶液滴定,当用去12.00 mL时蓝色刚好褪去(反应方程式为I2+2S2O32-===2I-+S4O62-),通过计算该加碘食盐中KIO3的含量为______mg/kg。由此可判定该食盐为________(填“合格”或“不合格”)产品。
(10分,每空2分)现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答问题:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡________移动(填“向左”、“向右”或“不”);另取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中 的比值将__________(填“增大”、“减小”或“无法确定”)。
的比值将__________(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)________pH(乙) (填“大于”、“小于”或“等于”)。
(3)取25 mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为:c(Na+)________c(CH3COO-)。(填“大于”、“小于”或“等于”)。
(4)室温下,现有pH=2的醋酸溶液与PH=12的氨水,等体积混合后,溶液呈中性,则溶液中离子浓度的大小关系:______________
(10分,每空2分)水的电离平衡曲线如图所示。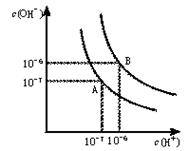
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从增加到。
(2)将pH=8的NaOH溶液与pH=5的稀盐酸混合,并且保持100℃的恒温,欲使混合溶液pH=7,则NaOH与盐酸的体积比为。
(3)普通泡沫灭火器是利用NaHCO3溶液跟Al2(SO4)3溶液混合,产生大量的气体和沉淀,气体将混合物压出灭火器,相关反应的离子方程式是。
(4)室温时,Mg(OH)2(S) Mg2+(aq)+2OH-(aq) 当Mg2+沉淀完全 (指Mg2+的浓度等于10-5mol/L) 时,溶液的pH=_______。已知25℃时Ksp[Mg(OH)2]=1.0×10-11,
Mg2+(aq)+2OH-(aq) 当Mg2+沉淀完全 (指Mg2+的浓度等于10-5mol/L) 时,溶液的pH=_______。已知25℃时Ksp[Mg(OH)2]=1.0×10-11,
(10分每空2分)室温下,在一个容积为1L的密闭容器中,充入1molN2和3molH2,发生反应:N2+3H2 2NH3,5min后到达平衡,平衡后混合气体的压强为起始压强的3\4,此时放出的热量为42KJ,则:
2NH3,5min后到达平衡,平衡后混合气体的压强为起始压强的3\4,此时放出的热量为42KJ,则:
(1)平衡时N2的物质的量为mol
(2)5min内用H2表示的反应速率为mol/(L.min)
(3)若向该1L密闭容器中再充入1molN2,则H2的转化率(填变大、变小或不变)
(4)写出N2和H2反应生成NH3的热化学反应方程式:
(5)写出该反应的平衡常数的表达式:
工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO (g) + 2H2 (g)  CH3OH (g)△H=-116kJ/mol
CH3OH (g)△H=-116kJ/mol
(1)该反应的化学平衡常数表达式为;
(2)下列措施中有利于增大该反应的反应速率且提高转化率的是(填字母序号) 。
a.随时将CH3OH与反应混合物分离b.降低反应温度
c.使用高效催化剂 d.增大体系压强
(3)一定条件下,将1 mol CO与3 mol H2的混合气体在催化剂作用下发生反应生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是(填字母序号).
a.c ( H2 )减少
b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加
d.重新平衡c ( H2 )/ c (CH3OH )减小
(4)在密闭容器中充有1mol CO与2 mol H2,在催化剂作用下反应生成甲醇,CO的转化率(α)与温度(T)、压强(P)的关系如图所示。
①A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间,tAtC(填于“大于”、“小于”或“等于”)。
②若A点时容器的体积为1 L,该温度下B点的平衡常数K= 。
现有反应:mA(g)+ B(g) 2C(g),达到平衡后,当升高温度时,A的转化率变小;当减小压强时,混合体系中C的质量分数不变,则:
2C(g),达到平衡后,当升高温度时,A的转化率变小;当减小压强时,混合体系中C的质量分数不变,则:
(1)该反应的△H0(填“>”或“<”),且m1(填“>”“=”“<”)。
(2)若加入B(假设容器的体积不变),则A的转化率,B的转化率。(填“增大”“减小”或“不变”)
(3)若B是有色物质,A、C均无色,则加入C(假设容器的体积不变)时混合物颜色,
若维持容器内压强不变,充入氖气时,混合物颜色(填“变深”“变浅”或“不变”)。
(4)一定温度下,向1L密闭容器中加入1mol C(g)使其分解,气体A的物质的量随时间的变化如下图所示。
则0~2 min内的平均反应速率υ(C)=。