有甲、丙两种物质:

甲 丙
由甲出发合成丙的路线之一如下: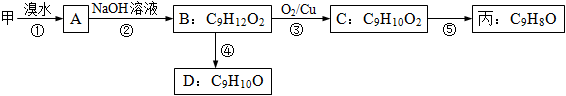
(1)下列物质不能与B反应的是 (选填序号)。
a.金属钠 b.FeCl3 c.碳酸钠溶液 d.HBr
(2)C的结构简式为___ ________;丙的结构简式为 。
(3)D符合下列条件的所有同分异构体 种,任写其中一种能同时满足下列条件的异构体结构简式 。
a.苯环上的一氯代物有两种
b.遇FeCl3溶液发生显色反应
c.能与Br2/CCl4发生加成反应
糖类、蛋白质是基本的营养物质,在我们的生活中扮演着及其重要的角色。如何正确识别这些物质的真伪,既检验同学们将化学知识应用于社会生活实际的能力,又可以减少伪劣物品对我们生活质量产生的负面影响。请选择下列鉴别试剂或鉴别方法:
| A.新制氢氧化铜 | B.碘水 | C.浓硝酸 | D.银氨溶液 E、燃烧 |
以及实验现象:① 烧焦羽毛味; ② 蓝色;③ 银镜(析出银);④黄色;
⑤ 砖红色沉淀用相应的序号填写下表:
葡萄糖是人体内最重要的供能物质,粮食中的糖类在人体中能转化成葡萄糖而被吸收。一部分葡萄糖在体内被氧化分解,最终生成二氧化碳和液态水,同时释放出能量,写出葡萄糖在体内氧化的化学方程式
油脂是一种重要的营养物质,在人体内水解生成高级脂肪酸和甘油(丙三醇),油脂的结构可表示为:__________________________________________。
芳香族化合物A有如下图的转化关系: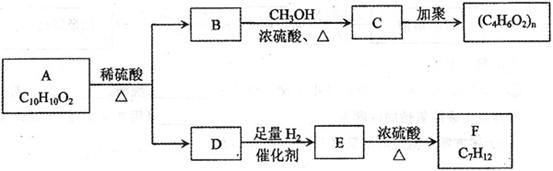
已知D能与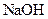 溶液反应,E转化为F时,产物只有一种结构,且能使溴的四氯化碳溶液褪色。请回答下列问题:
溶液反应,E转化为F时,产物只有一种结构,且能使溴的四氯化碳溶液褪色。请回答下列问题:
(1)B的分子式是_____________
(2)A、F的结构简式 A ___________ F __________
(3)写出B→C、E→F的化学反应方程式,并注明反应类型
B→C:_____________________________________________()
E→F:_____________________________________________()
(4)符合下列3个条件的A的同分异构体有多种
①苯环含有对二取代结构②遇 溶液不变色
溶液不变色
③能发生银镜反应
请写出其中任意一种的结构简式________________________________________
将1molCO和1molH2O充入某固定容积的反应器中,在某条件下达到平衡:
CO+H2O(g)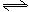 CO2+H2,此时有2/3的CO转化为CO2。
CO2+H2,此时有2/3的CO转化为CO2。
(1)该平衡混合物中CO2的体积分数为
(2)若容器体积为1L,到达平衡所需时间为2分钟,则H2的平均反应速率为
(3)若在相同条件下,向容器中充入1molCO2、1molH2和1molH2O,则达到平衡时与⑴中平衡相比较,平衡应向(填“正反应方向”、“逆反应方向”或“不”)移动,此时平衡混合物中CO2的体积分数可能是下列各值中的
| A.22.2% | B.27.55% | C.33.3% | D.36.8% |
(4)结合(3)中计算结果分析若平衡向正方向移动时,则下列说法中正确的是()
①生成物的产量一定增加;②生成物的体积分数一定增加;
③反应物的转化率一定增大; ④反应物的浓度一定降低;
⑤正反应速率一定大于逆反应速率;⑥一定使用了催化剂.