反应A(g)+B(s) C(g);△H<0,在其他条件不变时,改变其中一个条件,则生成C的速率:(填增大,减小或不变)
C(g);△H<0,在其他条件不变时,改变其中一个条件,则生成C的速率:(填增大,减小或不变)
(1) 升温___ ; (2) 增大压强____ ; (3) 增大容器容积 ____ ;
(4) 加正催化剂____ ; (5) 加入B____ 。
常温常压下,某气态烷烃与适量O2混合后的体积是4 L,两者恰好能完全燃烧,恢复到原状况,体积变为2 L,则该烷烃的结构简式是___________。
从理论上分析,碳原子数为10或小于10的烷烃分子中,其一卤代烷不存在同分异构体的烷烃共有4种。请写出它们的结构简式:
①____________________________________________________________________________;
②____________________________________________________________________________;
③____________________________________________________________________________;
④____________________________________________________________________________。
在烷烃分子中的基团:—CH3、—CH2—、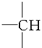 、
、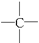 中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示。
中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示。
例如: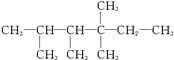
分子中,n1=6、n2=1、n3=2、n4=1。
试根据不同烷烃的组成结构,分析出烷烃(除甲烷外)各原子数的关系。
(1)烷烃分子中氢原子数n0与n1、n2、n3、n4之间的关系是n0=_______________。
(2)四种碳原子数之间的关系为n1=_______________。
(3)若分子中n2=n3=n4=1,则该分子的结构简式可能为(任写一种)_______________。
给下列有机物按系统命名法命名:
(1)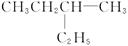 ______________________;
______________________;
(2)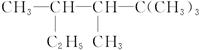 ___________;
___________;
(3)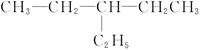 ___________;
___________;
(4)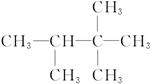 _________________。
_________________。
烷基的通式__________,甲基的电子式__________,乙烷的电子式__________,分子式为CmH20的烷烃中m为__________,分子式为C8Hn的烷烃中n为__________,与CO2密度相同(同温同压)的烷烃分子式为__________。