为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应的措施。化学反应的焓变一般通过实验进行测定,也可进行理论推算。
(1)实验测得,0.3mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量。写出上述燃烧反应的热化学方程式 。标准状况下11.2L乙硼烷完全燃烧生成液态水时放出的热量是 kJ。
(2)在化学反应过程中,拆开化学键需要吸收能量,形成化学键又会释放能量。已知拆开1mol氢气中的化学键需要消耗436kJ能量,拆开1mol氧气中的化学键需要消耗496kJ能量,形成水蒸气中的1mol H-O键能够释放463kJ能量。试说明反应2H2(g)+O2(g)=2H2O(g)中的能量变化。
a= ,b= 。又知1mol液态水转化成气态水吸收44 kJ能量,则氢气完全燃烧生成液态水时的热化学方程式为 。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。实验中不能直接测出由石墨和氢气生成甲烷反应的反应热,但可测出CH4、石墨和H2燃烧热分别如下:
①CH4(g)+2O2(g)=CO2(g)+2H2O ΔH1=-890.3 kJ•mol-1
②C(石墨)+O2(g)= CO2(g) ΔH2= —393.5 kJ•mol-1
③H2(g)+ O2(g)=H2O(l) ΔH3= ─285.8 kJ•mol-1
O2(g)=H2O(l) ΔH3= ─285.8 kJ•mol-1
④C(石墨)+2H2(g)= CH4(g) ΔH4
试根据盖斯定律求出石墨生成甲烷的反应热ΔH4= 。
 已知周期表中,元素
、
、
、
与元素
相邻。
的最高化合价氧化物的水化物是强酸。回答下列问题:
已知周期表中,元素
、
、
、
与元素
相邻。
的最高化合价氧化物的水化物是强酸。回答下列问题: (1)
与
可以形成一种高温结构陶瓷材料。
的氯化物分子呈正四面体结构,
的氧化物的晶体类型是;
(1)
与
可以形成一种高温结构陶瓷材料。
的氯化物分子呈正四面体结构,
的氧化物的晶体类型是; (2)
的具有相同化合价且可以相互转变的氧化物是;
(2)
的具有相同化合价且可以相互转变的氧化物是; (3)
和
形成的二价化合物中,
呈现最高化合价的化合物是化学式是;
(3)
和
形成的二价化合物中,
呈现最高化合价的化合物是化学式是; (4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式),其原因是
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式),其原因是 ②电子总数相同的氢化物的化学式和立体结构分别是
②电子总数相同的氢化物的化学式和立体结构分别是
 (5)
和
所形成的结构陶瓷材料的一种合成方法如下:
的氯化物与
的氢化物加热反应,生成化合物
和
气体;
在高温下分解生成
的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是
(5)
和
所形成的结构陶瓷材料的一种合成方法如下:
的氯化物与
的氢化物加热反应,生成化合物
和
气体;
在高温下分解生成
的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是
 化合物
是一种香料,存在于金橘中,可用如下路线合成:
化合物
是一种香料,存在于金橘中,可用如下路线合成:


已知:

 回答下列问题:
回答下列问题: (1)11.2
(标准状况)的烃
在氧气中充分燃烧可以产生88
和45
。
(1)11.2
(标准状况)的烃
在氧气中充分燃烧可以产生88
和45
。 的分子式是
的分子式是
 (2)
和
均为一氯代烃,它们的名称(系统命名)分别为;
(2)
和
均为一氯代烃,它们的名称(系统命名)分别为; (3)在催化剂存在下1
与2
反应,生成3-苯基-1-丙醇。F的结构简式是
(3)在催化剂存在下1
与2
反应,生成3-苯基-1-丙醇。F的结构简式是
 (4)反应①的反应类型是;
(4)反应①的反应类型是; (5)反应②的化学方程式为
(5)反应②的化学方程式为
 (6)写出所有与
具有相同官能团的
的芳香类同分异构体的结构简式:
(6)写出所有与
具有相同官能团的
的芳香类同分异构体的结构简式:

 浓
和木炭在加热时发生反应的化学方程式是
浓
和木炭在加热时发生反应的化学方程式是
 ↑
↑
↑
↑ 请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并要检出反应产物的装置。现提供浓
、木炭和酸性
溶液,其他固、液试剂自选。(连接和固定仪器所用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)
请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并要检出反应产物的装置。现提供浓
、木炭和酸性
溶液,其他固、液试剂自选。(连接和固定仪器所用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)
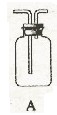


 将所选的仪器连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。
将所选的仪器连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。
选用的仪器 (填字母) (填字母) |
加入的试剂 |
作用 |
     |
   |
   |

化合物
相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,其余为氧。
的相关反应如下图所示:

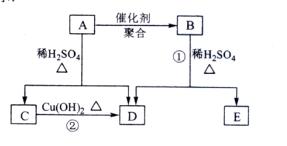

 已知
(烯醇)不稳定,很快转化为
。
已知
(烯醇)不稳定,很快转化为
。
 根据以上信息回答下列问题:
根据以上信息回答下列问题:
 (1)
的分子式为;
(1)
的分子式为;
 (2) 反应②的化学方程式是;
(2) 反应②的化学方程式是;
 (3)
的结构简式是;
(3)
的结构简式是;
 (4) 反应①的化学方程式是;
(4) 反应①的化学方程式是;
 (5)
有多种同分异构体,写出四个同时满足(i)能发生水解反应(ii)能使溴的四氯化碳溶液褪色两个条件的同分异构体的结构简式:;
(5)
有多种同分异构体,写出四个同时满足(i)能发生水解反应(ii)能使溴的四氯化碳溶液褪色两个条件的同分异构体的结构简式:;
 (6)
的另一种同分异构体,其分子中所有碳原子在一条直线上,它的结构简式为。
(6)
的另一种同分异构体,其分子中所有碳原子在一条直线上,它的结构简式为。

 现有
、
、
、
、
、
六种化合物,已知它们的阳离子有
,
现有
、
、
、
、
、
六种化合物,已知它们的阳离子有
, 阴离子有
,现将它们分别配成
的溶液,进行如下实验:
阴离子有
,现将它们分别配成
的溶液,进行如下实验:
①
 测得溶液
、
、
呈碱性,且碱性为
;
测得溶液
、
、
呈碱性,且碱性为
;
②
 向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③
 向D溶液中滴加
溶液,无明显现象;
向D溶液中滴加
溶液,无明显现象;
④
 向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
 根据上述实验现象,回答下列问题:
根据上述实验现象,回答下列问题:
(1)
 实验②中反应的化学方程式是
实验②中反应的化学方程式是
 ;
;
 (2)
溶液是,判断依据是
(2)
溶液是,判断依据是

 (3)写出下列四种化合物的化学式:
、
、
(3)写出下列四种化合物的化学式:
、
、
、
.