(1)①常温下,pH=3的盐酸和pH=11的氢氧化钡等 体积混合,溶液的pH= 。
②常温下pH=3的盐酸和pH=6的盐酸等体积混合,溶液的pH= 。(lg2=0.3)
(2)在某温度下,H2O的离子积常数为1×10-13,则该温度下
①某溶液中的H+浓度为1×10-7mol/L,则该溶液呈 性。
②0.01mol/LNaOH溶液的pH= 。
③99mL pH=1的H2SO4溶液与101mL pH=12的KOH溶液混合后,溶液的pH= 。
(10分)X、Y、Z是三种常见的短周期元素,可以形成XY2、Z2Y、XY3、Z2Y2、Z2X等化合物。已知Y的离子和Z的离子有相同的电子层结构,X离子比Y离子多1个电子层。
(1)X离子的结构示意图为________。
(2)Z2X属于________(共价或离子)化合物。
(3)Z2Y2中含有________键和________键,Z2Y2溶于水时发生反应的化学方程式是_______________。
A、B、C、D、E都是短周期元素,原子半径D>C>A>E>B,其中A、B处在同一周期,A、C 处在同一主族。C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍。试回答:
(1)C在元素周期表的第周期族。
(2)五种元素中,形成最简单的非金属氢化物的稳定性由大到小的顺序是(用分子表示)。
(3)B、D形成的原子个数比为1∶1的化合物的电子式是。
(4)E的一种氢化物叫肼,其分子中E原子与氢原子个数比为1 :2,肼的电子式。肼—空气燃料电池是一种环保碱性燃料电池,其电解质溶液是20%—30%的KOH溶液。该燃料电池的正极的电极反应式是____________。
(1)氢气可由天然气和水反应制备,其主要反应为:
CH4(g)+ 2H2O(g)  CO2(g)+4H2(g)
CO2(g)+4H2(g)
反应过程中能量变化如图所示:
则该反应为反应(填“吸热”或“放热”)。若已知,破坏1mol化学键需要吸收的热量如下代数式表示:
| 化学键 |
C—H |
O—H |
C=O |
H—H |
| 吸收热量(kJ/mol) |
a |
b |
c |
d |
则根据该反应制取1mol H2要吸收或放出热量为kJ(用含a b c d字母表示)。
(2)某温度下,10L密闭容器中充入1.8mol CH4和3mol H2O(g),发生CH4+2H2O(g)  CO2+4H2反应,反应进行到8s时CO2的浓度为0.08mol/L,则:
CO2+4H2反应,反应进行到8s时CO2的浓度为0.08mol/L,则:
①前8s以H2O(g)表示的平均反应速率为;
②8s时,混合气体中H2的体积分数为;
(I)下列装置能组成原电池的是(填序号)
(II)将CH4设计成燃料电池,装置如图所示(A、B为多孔碳棒)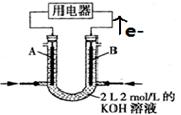
①(填A或B)处电极入口通甲烷,其电极反应式为;
②当消耗甲烷的体积为11.2 L(标准状况下)时,则导线中转移电子数为,消耗KOH的物质的量为。
有以下物质:①Ne;②NH4Cl;③KNO3;④NaOH;⑤Cl2;⑥SO2;⑦H2S;⑧Na2O2;⑨MgCl2。请用上述物质的数字序号填空:
(1)只存在离子键的是
(2)既存在离子键又存在极性键的是
(3)不存在化学键的是
(4)属于共价化合物的是