明矾石经处理后得到明矾【】。从明矾制备、和的工艺过程如下所示:
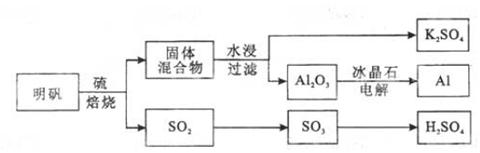
焙烧明矾的化学方程式为:
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是。
(2)从水浸后的滤液中得到晶体的方法是。

(3)在一定条件下可制得,其晶体结构如右图所示,该晶体中的配位数是。
(4)以和为电极,溶液为电解液组成一种新型电池,放电时转化为,该电池反应的化学方程式是。
(5)焙烧产生的可用于制硫酸。已知25℃、101时:
;
;
。
则与反应的热化学方程式是。
焙烧948明矾( ),若的利用率为96%,可生产质量分数为98%的硫酸。
下列物质中:⑴Na⑵ Br2⑶NaCl溶液⑷CO2 ⑸蔗糖⑹NH3⑺Na2O
⑻H2S气体⑼BaSO4⑽NaCl固体 ⑾Ba(OH)2。
属于电解质的是, 属于非电解质的是 ,能导电的是。(用序号填写)
如右图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的_____棒,乙池中的____棒。
②乙池中阳极的电极反应式是__ ___。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式____。
②甲池中碳极上电极反应式是__ ____,
乙池碳极上电极反应属于______(填“氧化反应”或“还原反应”)。
③将湿润的KI淀粉试纸放在乙池碳极附近,发现试纸变蓝,
反应的化学方程式为__ ______。
④若乙池转移0.02 mol e-后停止实验,恢复至室温,池中溶液体积是200 mL,则溶液混合均匀后的PH=______。
现有电解质溶液①Na2CO3,②NaHCO3,③NaAlO2,④CH3COONa,⑤NaOH
(1)当五种溶液的浓度相同时,溶液中由水电离出的H+的物质的量浓度由大到小的顺序是(填序号)。
(2)在上述五种电解质溶液中,分别加入AlCl3溶液,有气体产生的是(填序号)。
(3)将上述①②③④四种电解质溶液混合,发生反应的离子方程式为
常温下,将0.02molKOH和0.1molNH4Cl溶于水配成1L溶液,
(1)用离子方程式表示该溶液中存在的三个平衡体系:______、_____、______。
(2)溶液中共有种不同的粒子。
(3)这些粒子中浓度为0. 1mol/L的是(填元素符号),
浓度为0.02mol/L的是(填元素符号)。
(4)物质的量之和为0.1mol的二种粒子是______(填元素符号)。
纯水中c(H+)=5.0×10-7mol/L,则此时纯水中的c(OH-)=_____mol/L;若温度不变,滴入稀硫酸使c(H+)=5.0×10-3mol/L,则c(OH-)=______mol/L;在该温度时,往水中滴入NaOH溶液,溶液中的C(OH-)=5.0×10-2 mol/L,则溶液的PH值为。 (已知lg5=0.7,lg3=0.477)