二甲醚()是无色气体,可作为一种新型能源。由合成气(组成为、和少量的)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(i) + 2 = = -90.1•
(ii) + 3 = + = -49.0•
水煤气变换反应:
(iii) + = + = -41.1•
二甲醚合成反应:
(iV)2 = + = -24.5•回答下列问题:
(1)是合成气直接制备二甲醚反应催化剂的主要成分之一。工业上从铝土矿制备较高纯度的主要工艺流程是(以化学方程式表示)。
(2)分析二甲醚合成反应(iV)对于转化率的影响。
(3)由和直接制备二甲醚(另一产物为水蒸气)的热化学方程式为。根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响。
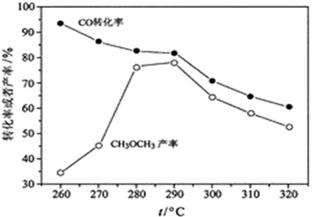
(4)有研究者在催化剂(含---和)、压强为5.0的条件下,由和直接制备二甲醚,结果如下图所示。其中转化率随温度升高而降低的原因是。
(5)二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度等于甲醇直接燃料电池(5.93••)。若电解质为酸性,二甲醚直接燃料电池的负极反应为,一个二甲醚分子经过电化学氧化,可以产生个电子的能量;该电池的理论输出电压为1.20,能量密度 =(列式计算。能量密度=电池输出电能/燃料质量,1 • = 3.6×106)。
冶炼金属常用以下几种方法:
A.以C、CO或H2做还原剂; B.热分解法;
C.利用铝热反应原理还原;D.电解法。
下列金属各采用哪种方法还原最佳。(用序号填写下列空白。)
(1)Fe、Zn、Cu等金属;(2)Na、Mg、Al等金属 ______ ;
(3)Hg、Ag等金属;(4)V、Cr、Mn、W等高熔点金属。
海带中含有的碘元素,以I-形式存在,因此可先用将其氧化为________,
然后利用这一特性检验。
在适宜的条件下,由CH2===CH2分子可自身相互加成而生成高分子化合物——聚乙烯,其化学反应方程式为,反应类型为。
在铝热反应 Fe2O3 + 2 Al  2 Fe + Al2O3中,作为氧化剂的物质是__(填化学式),作为还原剂的物质是(填化学式);
2 Fe + Al2O3中,作为氧化剂的物质是__(填化学式),作为还原剂的物质是(填化学式);
铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)所含铁元素既有氧化性又有还原性的物质是 ________(用字母代号填)。
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加1 mol/L FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是 ________nm。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_________________________________________________________。
某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
首先取少量待测溶液,滴入KSCN溶液呈红色,则溶液中含有的金属阳离子是_________________________,在此基础上,又进行了定量组成的测定:取50.0mL待测溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、干燥、称量,沉淀质量为43.05 g.溶液中c(Cl-)=mol/L.
(4)若要验证该溶液中含有Fe2+,正确的实验方法是。
A.向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe2+。
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+。
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(5)欲从废水中回收铜,并重新获得FeCl3溶液设计实验方案如下:
A请写出上述实验中加入或生成的有关物质的化学式:
①_____________②____________③______________④________________
B请写出通入⑥的化学方程式__________________________________