阅读下列实验内容,根据题目要求回答问题:
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14 mol·L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14 mol·L-1NaOH溶液滴定硫酸的实验操作如下:
| A.用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入指示剂。 |
| B.用待测定的溶液润洗酸式滴定管。 |
| C.用蒸馏水洗干净滴定管。 |
| D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。 |
E、检查滴定管是否漏水。
F、另取锥形瓶,再重复操作一次。
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写)___________________________ 。
②该滴定操作中应选用的指示剂是 ____________ 。
③在G操作中如何确定终点? __________________________ ____ 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果______________(填“偏小”、“偏大”或“无影响”)。
(3)配制准确浓度的稀H2SO4溶液,必须使用的主要容器是 ___________ 。
(4)如有1 mol·L-1和0.1 mol·L-1的NaOH溶液,应用________________ _的NaOH溶液,原因是__________________________ __________________________ 。
(5)用标准NaOH溶液滴定时,应将标准NaOH溶液注入 __(选填“甲”或“乙”)中。
(6)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值 (选填“偏大”“偏小”或“无影响”)
(7)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果保留到小数点后第二位) ___ 。
在实验室里制取某些有毒气体时,为了尽量防止毒气逸散造成空气污染,有人设计了如下图所示的装置[Ⅰ]。并设想用[Ⅱ]或[Ⅲ]两种装置代替[Ⅰ]的b~c部分,以求达到同样的目的。
试回答:
(1) 若用[Ⅰ]制取氯气,b瓶加入的液体一般为 ______________。在选取试剂正确且适量的前题下,反应开始后,当关闭活塞K时,如若发现c中液面不明显上升,你分析可能的原因是 ,检查的简单方法是 。
(2) 装置(Ⅰ)中b能防止多余气体逸散的原因是: 。
(3) 欲用[Ⅱ]或[Ⅲ]代替[Ⅰ]中的b~c部分(选用液体相同),是否可行?说明理由。
[Ⅱ]是否可行(填“是”或“否”) 理由是: 。
[Ⅲ]是否可行(填“是”或“否”) 理由是: 。
某学生用胆矾制取氧化铜固体,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用。实验步骤如下:
①称量a g胆矾固体放入烧杯中,加水制成溶液,向其中滴加氢氧化钠溶液至沉淀完全;
②把步骤①中的溶液和沉淀转移至蒸发皿中,加热至溶液中的沉淀全变成黑色氧化铜为止;
③过滤、洗涤、干燥,称量所得固体质量为b g;
④取一定质量的上述氧化铜固体和一定质量的氯酸钾固体,混合均匀后加热,收集反应生成的氧气,如图所示。
请回答下列问题:
(1)上述各步操作中,需要用到玻璃棒的是__________________(填写前面所述实验步骤的序号)。
(2)由胆矾制备氧化铜的产率(实际产量与理论产量的百分比)为____________×100%。
(3)为保证Cu2+沉淀完全,步骤①中溶液的pH应大于10。简述测定溶液pH的操作:____________________________ 。
(4)为证明氧化铜在氯酸钾的分解反应中起催化作用,在上述实验①~④后还应该进行的实验操作是 (按实验先后顺序填写字母序号)。
a过滤b烘干c溶解d洗涤e称量
(5)但有同学认为,还必须另外再设计一个实验才能证明氧化铜在氯酸钾受热分解的实验中起催化作用。你认为还应该进行的另一个实验是 。
Ⅰ.拟用下图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。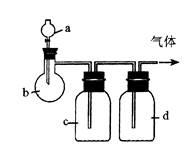
| 气体 |
a |
b |
c |
d |
| C2H4 |
乙醇 |
浓H2SO4 |
NaOH溶液 |
浓H2SO4 |
| Cl2 |
浓盐酸 |
MnO2 |
NaOH溶液 |
浓H2SO4 |
| NH3 |
饱和NH4Cl溶液 |
消石灰 |
H2O |
固体NaOH |
| NO |
稀HNO3 |
铜屑 |
H2O |
P2O5 |
(1)上述方法中可以得到干燥、纯净的气体是 。
(2)指出不能用上述方法制取的气体,并说明理由(可以不填满)
① 气体_____________,理由是____________________________ 。
② 气体_____________,理由是____________________________ 。
③ 气体_____________,理由是____________________________ 。
④ 气体_____________,理由是____________________________ 。
Ⅱ.用下图装置进行实验,将A逐滴加入B 中。
(1)若A为醋酸,B为石灰石,C为C6H5ONa溶液,则在 小试管中发生的现象是_______________,其中发生反应的化学方程式为_______________________。
(2)若B为生石灰,实验中观察到C溶液中先产生沉淀,而后沉淀逐渐溶解。当沉淀恰好溶解时,关闭E,然后向烧杯中加入热水,静置片刻,观察到试管壁上出现银镜。则A是_________,C是__________和乙醛的混合液,发生银镜反应的化学方程式为____________________________仪器D在实验中的作用是__________________。
海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(以让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘: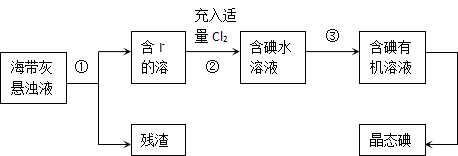
(1)指出上图中提取碘的过程中有关的实验操作名称:① 。
(2)操作③中所用的有机试剂可以是 (只填一种)。
(3)操作过程③可以分解为如下几步:
| A.把盛有溶液的分液漏斗放在铁架台的铁圈中; |
| B.把50ml碘水和15ml有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞; |
| C.检验分液漏斗活塞和上口的玻璃塞是否漏液; |
| D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正; |
E. 旋开活塞,用烧杯接收溶液;
F. 从分液漏斗上口倒出上层液体;
G. 将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H. 静置、分层。
(a)过程③正确操作步骤的顺序是:(填编号字母) ;
(b)上述G步操作的目的是: ;
(c)最后碘的有机溶液是通过 获得(填“漏斗上口”或“漏斗下口”)。
(4)从含碘的有机溶液中提取碘和回收有机试剂,还需要经过蒸馏,观察图所示实验装置指出其错误之处 。
实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
(1)在图所示仪器中,配制上述溶液肯定不需要的是______(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是______.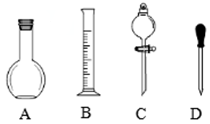
(2)在容量瓶的使用方法中,下列操作不正确的是______
| A.使用容量瓶前检验是否漏水 |
| B.容量瓶用水洗净后,再用待配溶液洗涤 |
| C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线. |
| D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线. |
E.盖好瓶塞,用食指顶住瓶塞,另一只手的手指托住瓶底,把容量瓶反复倒转多次,摇匀.
(3)根据计算用托盘天平称取NaOH固体的质量为______g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度______0.1mol/L(填“大于”“小于”或“等于”).
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为______mL,如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好.