研究NO2、SO2、CO等大气污染气体的处理以及燃料的开发与利用有重要意义。
(1)NO2可用水吸收,利用反应6NO2+8NH3 7N2+12H2O
7N2+12H2O
也可以处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是______________L。
(2)已知:2SO2(g)+ O2 (g)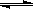 2SO3 (g) △H =-196.6kJ·mol-1
2SO3 (g) △H =-196.6kJ·mol-1
2NO(g)+ O2 (g) 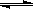 2NO2 (g) △H =-113.0kJ·mol-1
2NO2 (g) △H =-113.0kJ·mol-1
则反应NO2(g)+ SO2 (g) 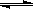 SO3 (g) +NO(g)的△H =______kJ·mol-1
SO3 (g) +NO(g)的△H =______kJ·mol-1
(3)CO可用于合成甲醇,反应方程式为CO(g)+ 2H2 (g) 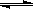 CH3OH (g)。由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用1个月充电一次。假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-
CH3OH (g)。由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用1个月充电一次。假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-
①该电池反应的总离子方程式为____________________________________________。
②甲醇在____极发生反应(填正或负),电池在放电过程中溶液的pH将____________(填降低或上升、不变);若有16克甲醇蒸气被完全氧化,产生的电能电解足量的CuSO4溶液,(假设整个过程中能量利用率为80%),则将产生标准状况下的O2________________升。
某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质。某化学课外小组设计以下流程,取该矿样为原料生产CuC12·2H2O 晶体。
已知:常温下,金属离子开始沉淀和沉淀完全时的pH 见下表。
| 金属离子 |
氢氧化物开始沉淀的pH |
氢氧化物沉淀完全的pH |
| Fe2+ |
7.0 |
9.0 |
| Fe3+ |
1.9 |
3.2 |
| Cu2+ |
4.7 |
6.7 |
回答下列问题:
(l)步骤①的焙烧过程中需要通入氧气。在实验室中,可使用常见化学物质利用上图所示装置制取氧气,试写出熟悉的符合上述条件的两个化学方程式:______________________、______________________。
(2)焙烧产生的尾气中含有的一种气体是形成酸雨的污染物,若将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:____________________、__________________。
(3)步骤②酸浸过程中,需要用到3 mol · L-1的盐酸100 mL,配制该盐酸溶液时,除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有_______________________________________。
(4)步骤④加入物质X的目的是_________________________________________,物质X 可以选用下列物质中的______________________。
(A)氢氧化钠(B)稀盐酸(C)氨水(D)氧化铜
(5)当溶液中金属离子浓度低于1×10-5 mol · L-1时,认为该金属离子沉淀完全,则Ksp[Fe(OH)2]=_____。
平衡指的是两个相反方向的变化最后所处的运动状态;在平衡时,两种变化仍在继续进行,但是它们的速率相等;根据变化的性质可分为物理平衡和化学平衡,中学阶段涉及的平衡有气体可逆反应的平衡、酸碱电离平衡、水解平衡及沉淀-溶解平衡等等。
(1)现有容积为1 L的恒温恒容密闭容器,向其中加入2 mol A气体和2 mol B气体后发生如下反应:A(g)+B(g) C(g) △H=" -" a kJ·mol-1,20s后,反应达到平衡状态,生成1 mol C气体,放出热量Q1kJ。回答下列问题。
C(g) △H=" -" a kJ·mol-1,20s后,反应达到平衡状态,生成1 mol C气体,放出热量Q1kJ。回答下列问题。
①计算20s内B气体的平均化学反应速率为___________,写出该反应的平衡常数表达式___________。
②保持容器温度和容积不变,若改为向其中加入1molC气体,反应达到平衡时,吸收热量Q2kJ,则Q1 与Q2的相互关系正确的是____________(填字母)。
(A)Q1 + Q2 = a(B) Q1 + 2Q2 < 2a(C)Q1 + 2Q2 > 2a(D)Q1 + Q2 < a
③在原平衡基础上,保持容器温度和容积不变,向容器中再通入bmolA气体(b>0)时,v(正)_____v(逆)(填“>”、“<”或“=”),重新达平衡后,C气体的平衡体积分数 (C) =
(C) =  ,则b = ____________。
,则b = ____________。
(2)常温下,将VmL、0.1000mol·L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol·L-1醋酸溶液中,充分反应。回答下列问题。(忽略溶液体积的变化)
①如果溶液pH=7,此时V的取值_____20.00(填“>”、“<”或“=”),而溶液中c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为_____________________________________________。
②如果V=40.00,则此时溶液中c(OH-) -c(H+) - c(CH3COOH)= ___________________mol·L-1。
工业上利用硫酸渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3)和回收(NH4)2SO4,具体生产流程如下:
(1)在废渣溶解时需要使用酸,应选用__________,为了提高废渣的浸取率,可采用的措施有哪些?
_____________________________________________________________(至少写出两点)。
(2)物质A是一种氧化剂,工业上最好选用_____________(供选择使用的有:空气、Cl2、MnO2),其理由是(至少写出两点)。
(3)“结晶”反应的化学方程式为__________________________________________________。
(4)上述生产流程中多处采用了过滤操作,实验室中完成相应的操作需要用到的玻璃仪器有烧杯及____________________________________________。
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)画出元素Y 的原子结构示意图
(2)X与W组成的化合物中存在键(填“离子”“共价”)。
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A
①已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。写出加热条件下A与NaOH溶液反应的离子方程式。
②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式
。
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1 mol B中含有6mol结晶水。对化合物B进行如下实验:
a 取B的溶液加入过量浓NaOH溶液并加热,无色刺激性气味气体和白色沉淀。白色沉淀变为灰绿色,最终变为红褐色;
b 另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
B的化学式为。
②已知1 mol·L—1 100mL B的溶液能与1 mol·L—1 20mLKMnO4溶液(硫酸酸化)恰好反应。写出反应的离子方程式
A、B、C、D都是由短周期元素组成的常见物质,其中A、B、C均含同一种元素,在一定条件下相互转化关系如下图所示(部分产物已略去)。
请按要求回答下列问题:
(1)若B、C 为氧化物,C能够与水反应生成一种强酸。
①当B为无色易溶于水的刺激性气体时,写出B转化为C的化学方程式:
。
②当B为无色不溶于水的气体时,写出C与水反应的化学方程式:
(2)若D为氧化物,A、B、C都是强电解质,C可用于食品发酵、泡沫灭火。写出A与D反应的离子方程式:
(3)若D为强酸或强碱溶液时都能发生图示转化关系,且A和C在溶液中反应生成白色沉淀B。
当D为强酸时,A→B反应的离子方程式:;
当D为强碱时,B→C反应的离子方程式:.