重铬酸钠(Na2Cr2O7•2H2O)俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿(主要成份为FeO•Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:
中涉及的主要反应有:
主反应:4FeO•Cr2O3+8Na2CO3+7O2  8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应: SiO2+Na2CO3 Na2SiO3+CO2↑ Al2O3+Na2CO3
Na2SiO3+CO2↑ Al2O3+Na2CO3 2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Mg(OH)2 |
Cr(OH)3 |
| 完全沉淀时溶液pH |
4.7 |
3.7 |
11.2 |
5.6 |
试回答下列问题:
(1)“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 ;
(2)“③”中调节pH至4.7,目的是 ;
(3)“⑤”中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式: ;
(4)称取重铬酸钠试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol•L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol•L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)
①判断达到滴定终点的依据是: 。
②若实验中共用去Na2S2O3标准溶液40.00ml,所得产品的中重铬酸钠的纯度 (设整个过程中其它杂质不参与反应) 。
实验室需要制备纯净的氯化钾。现有含少量KBr和K2SO4的氯化钾样品,按照下图所示的实验方案进行提纯。
(1)过滤时需要用到的玻璃仪器是。
(2)检验加入BaCl2溶液后SO42-是否沉淀完全的操作为。
(3)若用硝酸钡来代替氯化钡,请判断是否可行,并说明理由。
(4)某同学认为该实验方案中加适量氯化钡溶液不容易控制,应加入过量氯化钡溶液。
他的思路如下:
沉淀A的化学式是,溶液③中的溶质是。
现代循环经济要求综合考虑环境污染和经济效益。请填写下列空白。
(1)实验室里,可用于吸收SO2尾气的一种试剂是。
(2)高纯氧化铁可作现代电子工业材料。以下是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、 FeO、SiO2)为原料制备高纯氧化铁(软磁α- Fe2O3)的生产流程示意图:
①步骤I中过滤所得滤渣的主要成分是。
②步骤II中加入铁粉的目的是。
③步骤Ⅲ中可选用试剂调节溶液的pH(填标号)。
| A.稀硝酸 | B.双氧水 | C.氨水 | D.高锰酸钾溶液 |
④写出在空气中煅烧FeCO3,制备高纯氧化铁的化学方程式。
⑤从滤液C中回收的主要物质的一种用途是。
50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________。
(2)大烧杯上如不盖硬纸板,求得的中和热数值将_______(填“偏大”、“偏小”或“无影响”)。
(3)实验中改用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比较,所放出的热量________(填“相等”或“不相等”),但中和热应_________(填“相等”或“不相等”),简述理由_________________________________。
《硫酸铜晶体里结晶水含量的测定》是中学化学中的重要实验,请回答下列该实验的相关问题。
(1)实验中能直接加热的仪器名称为____________;进行的称量操作至少为________次。
(2)下列操作会引起测定结果偏高的是__________________
| A.加热时温度过高CuSO4发生分解 | B.加热后在空气中冷却再称量 |
| C.加热过程中有晶体溅出 | D.晶体部分风化 |
市场销售的某种食用精制盐包装袋上有如下说明(部分):
| 产品标准 |
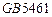 |
| 产品等级 |
一级 |
| 配料 |
食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) |
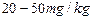 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):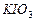 +
+ +
+ 4 =""
4 =""  +
+ +
+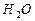
(2)上述反应生成的 可用四氯化碳检验。向碘的四氯化碳溶液中加入
可用四氯化碳检验。向碘的四氯化碳溶液中加入 稀溶液,将
稀溶液,将 还原,以回收四氯化碳。
还原,以回收四氯化碳。
① 稀溶液与
稀溶液与 反应的离子方程式是
反应的离子方程式是
②某学生设计回收四氯化碳的操作步骤为:
a、将碘的四氯化碳溶液置于分液漏斗中; b、加入适量 稀溶液;
稀溶液;
c、分离出下层液体。
以上设计中遗漏的操作及在上述操作中的位置是
(3)已知:
某学生测定食用精制盐的碘含量,其步骤为:
a、准确称取 食盐,加适量蒸馏水使其完全溶解;
食盐,加适量蒸馏水使其完全溶解;
b、用稀硫酸酸化所得溶液,加入足量 溶液,使食用盐中
溶液,使食用盐中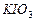 与
与 反应完全;
反应完全;
c、以淀粉溶液为指示剂,逐滴加入物质的量浓度为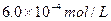 的
的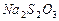 溶液
溶液 ,恰好反应完全。
,恰好反应完全。
①判断c中反应恰好完全依据的现象是
②根据以上实验和包装说明,所测精盐的碘含量是