下列关于实验原理或操作的叙述中,正确的是
| A.可用重结晶法提纯含少量氯化钠杂质的硝酸钾晶体 |
| B.可摘下几根火柴头,将其浸入水中,所刻后取少量溶液于试管中,滴加硝酸银和稀硝酸以检验其中的氯元素 |
| C.“硝基苯制备”实验中,将硝酸与苯混合后再滴加浓硫酸 |
| D.实验时手指不小心沾上苯酚,立即用70℃以上的热水冲洗 |
下列各组数据中比值不为1:1的是
| A.100℃时,pH=6的纯水中,c(OH-)与c(H+)之比 |
B.常温下,pH=1的HF溶液与 的盐酸中 的盐酸中 之比 之比 |
| C.常温下,pH=7的CH3COOH与CH3COONa的混合溶液中,c(CH3COO-)与c(Na+)之比 |
| D.常温下,pH=12的Ba(OH)2溶液与pH=12的KOH溶液中溶质的物质的量浓度之比 |
常温下,pH=11的氨水和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应,则下列说法不正确的是
| A.弱碱的浓度大于强酸的浓度 |
| B.反应后的溶液呈酸性 |
C.原氨水中有1%的含氮微粒为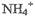 |
D.反应后的溶液中 三种微粒的平衡浓度之和为 三种微粒的平衡浓度之和为 |
下列叙述正确的是
| A.95℃纯水的pH<7,说明加热可导致水呈酸性 |
| B.pH=3的醋酸溶液,稀释至10倍后pH=4 |
| C.0.2mo1/L的盐酸,与等体积水混合后pH=1 |
| D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7 |
下列溶液一定呈中性的是
| A.pH=7的溶液 |
| B.c(H+)=c(OH-)的溶液 |
| C.由强酸、强碱等物质的量反应得到的溶液 |
| D.非电解质溶于水得到的溶液 |
对于平衡体系mA(g)+nB(g)  pC(g)+qD(g);△H<0,下列结论中不正确的是
pC(g)+qD(g);△H<0,下列结论中不正确的是
A、若温度不变,将容器的体积缩小到原来的一半,此时A的浓度变为原来的2.1倍,则m+n<p+q
B、若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C、若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到平衡时,气体的总物质的量等于2a
D、若温度不变时,压强增大到原来的2倍,达到新平衡时,总体积一定比原来1/2要小