I.煤化工中常需研究不同溫度下平衡常数、投料比等问题。
已知:CO (g) +H2O(g) H2(g) +CO2(g)平衡常数K随温度的变化如下表:
H2(g) +CO2(g)平衡常数K随温度的变化如下表:
回答下列问题
(1)该反应的平衡常数表达式K=______,ΔH=______0(填“<”、“>”、“=”)
(2)已知在一定温度下,CCs) +CO2(g) 2C0 Cg)平衡常数K1;
2C0 Cg)平衡常数K1;
C (s) +H2O(g) CO Cg) +H2(g)平衡常数K2
CO Cg) +H2(g)平衡常数K2
则K、K1 、K2,之间的关系是______:
(3)8000C时,向一个10L的恒容反应器中充入0.40molCO和1.60mol水蒸气,经一段时 间后反应达到平衡,此时CO的转化率为:若保持其他条件不变,向平衡体系中 再通入0.10molCO和0.40molCO2,此时v正______v逆 (填“>”、“=”或“<”)。
II.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。
(4) 向酸性KmnO4溶液中加入一定量的H2C2O4溶液,当溶液中的KmnO4耗尽后,紫色溶液将褪去。为确保能观察到紫色褪去,H2C2O4与KmnO4初始的物质的量需要满足的关 系为n(H2C2O4): n(KMnO4) ______。
(5) 为探究反应物浓度对化学反应速率的影响,该小组设计了如下实验方案
表中x= ______ml ,理由是______。
(6) 已知50°C时,浓度c(H2C2O4)随反应时间t的变化曲线如图示,若保持其他条件不变,请在答题卡坐标图 中画出25°C时c(H2C2O4)随t的变化曲线示意图。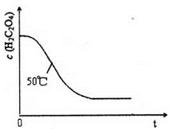
已知反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH="a" kJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g)
FeO(s)+CO(g) ΔH="a" kJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g) CO2(g) ΔH="b" kJ·mol-1;反应③Fe2O3(s)+3CO(g)
CO2(g) ΔH="b" kJ·mol-1;反应③Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ΔH="c" kJ·mol-1。测得在不同温度下,K值如下:
2Fe(s)+3CO2(g) ΔH="c" kJ·mol-1。测得在不同温度下,K值如下:
| 温度/℃ |
500 |
700 |
900 |
| K |
1.00 |
1.47 |
2.40 |
(1)若500 ℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为 。
(2)反应①为 (选填“吸热”或“放热”)反应。
(3)700 ℃时反应①达到平衡状态,要使该平衡向右移动,其他条件不变时,可以采取的措施有 (填序号)。
A.缩小反应器体积 B.通入CO2 C.温度升高到900 ℃ D.使用合适的催化剂
E.增加Fe的量
(4)下列图像符合反应①的是 (填序号)(图中v为速率,φ为混合物中CO含量,T为温度且T1>T2)。
(5)由反应①和②可求得,反应2Fe(s)+O2(g) 2FeO(s)的ΔH= 。
2FeO(s)的ΔH= 。
(6)请运用盖斯定律写出Fe(固体)被O2(气体)氧化得到Fe2O3(固体)的热化学方程式: 。
甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过反应Ⅰ和Ⅱ来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100 L),在一定条件下发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ。CH4的转化率与温度、压强的关系如下图。
CO(g)+3H2(g)……Ⅰ。CH4的转化率与温度、压强的关系如下图。
①已知100 ℃压强为p1时达到平衡所需的时间为5 min,则用H2表示的平均反应速率为 。
②图中的p1 p2(填“<”“>”或“="”),100" ℃压强为p2时平衡常数为 。
③该反应的ΔH 0(填“<”“>”或“=”)。
(2)在一定条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇: CO(g)+2H2(g) CH3OH(g) ΔH<0 ……Ⅱ
CH3OH(g) ΔH<0 ……Ⅱ
①若容器容积不变,下列措施可增加甲醇产率的是( )
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1 mol CO和3 mol H2
②为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验表格中。
A.下表中剩余的实验条件数据:a= ;b= 。
。
B.根据反应Ⅱ的特点,下图是在压强分别为0.1 MPa和5 MPa下CO的转化率随温度变化的曲线图,请指明图中的压强px= MPa。
| 实验编号 |
T/℃ |
n(CO)/n(H2) |
p/MPa |
| 1 |
150 |
1/3 |
0.1 |
| 2 |
a |
1/3 |
5 |
| 3 |
350 |
b |
5 |

丙酸的结构为CH3—CH2—COOH,丙酸盐是安全有效的防霉、防腐剂,一种以碱式碳酸锌为原料的生产工艺流程如下:
| 序号 |
n(丙酸)∶ n(碱式碳酸锌) |
反应温度/℃ |
丙酸锌产率/% |
| 1 |
1∶0.25 |
60 |
67.2 |
| 2 |
1∶0.25 |
80 |
83.5 |
| 3 |
1∶0.25 |
100 |
81.4 |
| 4 |
1∶0.31 |
60 |
89.2 |
| 5 |
1∶0.31 |
80 |
90.1 |
| 6 |
1∶0.31 |
100 |
88.8 |
(1)探究本实验中最佳工艺条件(见上表):反应时间2 h,用水量45 g,n(丙酸)∶n(碱式碳酸锌)=1∶ ,反应温度 ℃。
,反应温度 ℃。
(2)本工艺采用“闭路循环”方式,除具有制备工艺简便、产率高外,还具有 的优点。
(3)某次实验时,将37.0 g丙酸溶于220 mL水中,按上述流程在上述优化的条件下制备,最终得丙酸锌49.6 g,则该次实验丙酸锌的产率为 (写出计算过程)。
Ⅰ.已知:H2A的A2-可表示S2-、S 、S
、S 、Si
、Si 或C
或C 等离子。
等离子。
(1)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空:
①当V(NaOH)="20" mL时,溶液中离子浓度大小关系: 。
②等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水 (填“大”“小”或“相等”),欲使NaHA溶液呈中性,可以向其中加入 。
(2)若H2A为硫酸:t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数KW= 。
Ⅱ.已知:在25 ℃时 H2O H++OH- KW=10-14
H++OH- KW=10-14
CH3COOH H++CH3COO- Ka=1.8×10-5
H++CH3COO- Ka=1.8×10-5
(3)醋酸钠水解的平衡常数Kh的表达式为 ,具体数值= ,当升高温度时,Kh将 (填“增大”“减小”或“不变”)。
(4)0.5 mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1 mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 。(填“大于”“小于”或“等于”)
Ⅲ.(5)25 ℃时,将a mol·L-1的氨水与b mol·L-1盐酸等体积混合,反应后溶液恰好显中性,则a b(填“大于”“小于”或“等于”)。用a、b表示NH3·H2O的电离平衡常数为 。
b(填“大于”“小于”或“等于”)。用a、b表示NH3·H2O的电离平衡常数为 。
pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3mol·L-1,则该溶液中溶质的pC=-lg(1×10-3)=3。下图为,H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC—pH图。请回答下列问题:
(1)在人体血液中,HC 能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。
能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。
②正常人体血液中,HC 的水解程度 电离程度(填“<”“>”或“=”)。
的水解程度 电离程度(填“<”“>”或“=”)。
③pH=7.00的血液中,c(H2CO3) c(HC )(填“<”“>”或“=”)。
)(填“<”“>”或“=”)。
(2)H2CO3一级电离平衡常数的数值 ≈ 。
≈ 。
(3)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的C 不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确
不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确
。
(4)已知某温度下Li2CO3的Ksp为1.68×10-3,将适量Li2CO3固体溶于100 mL水中至刚好饱和,饱和Li2CO3溶液中c(Li+)="0.15" mol·L-1、c(C )="0.075" mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
)="0.075" mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。