有A、B、C、D、E、F六种前四周期的元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D和F元素对应的单质为日常生活中常见金属。A原子核内只有一个质子,元素A与B形成的气态化合物甲具有10e-、空间构型为三角锥形,C元素原子的最外层电子数是其电子层数的3倍,C与E同主族。下图中均含D或F元素的物质均会有图示转化关系:
①均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;
②均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应。请回答下列问题:
(1)化合物甲的电子式为 。
(2)F元素在周期表中的位置 ;稳定性:A2C A2E(填“大于”“小于” “等于”)。
(3)均含有D元素的乙与丁在溶液中发生反应的离子方程式 。
(4)丙、丁分别是含F元素的简单阳离子,检验含丙、丁两种离子的混合溶液中的低价离子,可以用酸性KMnO4溶液,其对应的离子方程式为:
(5)已知常温下化合物FE的Ksp=6×10-18 mol2·L-2,常温下将1.0×10-5mol·L-1的Na2E溶液与含FSO4溶液按体积比3 :2混合,若有沉淀F E生成,则所需的FSO4的浓度要求 。(忽略混合后溶液的体积变化)。
由短周期元素组成的A、B两种盐可发生下列变化,且B的焰色反应呈黄色(其它生成物未在图中列出)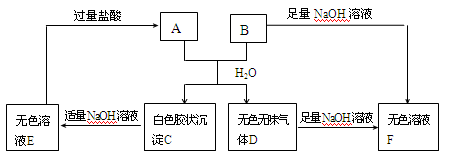
(1)无色溶液F中,一定含有的溶质的化学式为。
(2)写出白色胶状沉淀C转化为无色溶液E的离子方程式________________。
(3)A和B的混合物溶于水发生反应的离子方程式______________________。
(4)将B与E的溶液混合时,可观察到的现象是_________________________,写出其反应的离子方程式__________________________________________。
下图各方框内字母均表示一步反应中的某些反应物或生成物,其中X与C焰色反应均呈黄色,X分解时以1:1:1的比例得到化合物A、B、C,常温下A为一种常见的无色液体,B、D为无色气体,B是酸雨污染的主要原因,实验室中常用C与F的浓溶液反应来制备少量的B。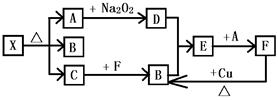
(1)写出下列各物质的化学式:A,B,C,E。
(2)①写出框图中下列转化的化学方程式:F与Cu作用生成B;C与F生成B;
②工业上制备F的工艺方法被称为,生成B的设备名称为,此法产生的含有B的废气常用C的水溶液作为吸收剂,写出吸收生成X的离子方程式。
A溶液和B溶液按如下程序进行实验,根据下述现象判断: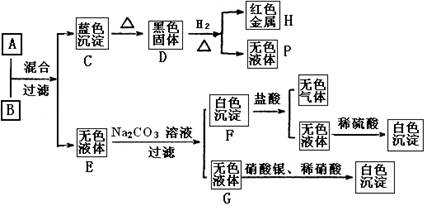
(1)A溶液中的溶质的化学式,B溶液中的溶质的化学式。
(2)完成下列转化的化学方程式,并用“单线桥法”标明电子转移的方向和数目:
D+H2=H+P:
(3)写出下列反应的离子方程式:
A+B:
F+盐酸:
(4)溶液B中阴离子的检验方法是
慢心律是一种治疗心律失常的药物,它的合成路线如下: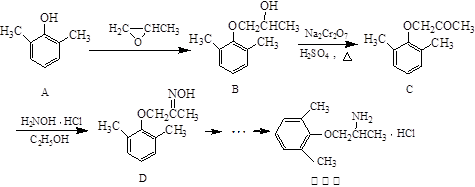
(1)由B→C的反应类型为。
(2)写出A与NaOH反应的化学方程式。
(3)由A制备B的过程中有少量副产物E,它与B互为同分异构体,E的结构简式为。
(4)写出同时满足下列条件的D的一种同分异构体的结构简式。
①属于 -氨基酸;
-氨基酸;
②是苯的衍生物,且苯环上的一氯代物只有两种;
③分子中含有两个甲基。
(5)已知乙烯在催化剂作用下与氧气反应可以生成环氧乙烷(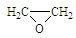 )。写出以邻甲基苯酚(
)。写出以邻甲基苯酚(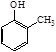 )和乙醇为原料制备
)和乙醇为原料制备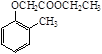 的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
(14分)乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化为烃B、烃C。以C为原料可以合成聚对羟基苯甲酸 (G)。已知:
(1)A是一种有机酸,分子式为C9H10O3。
(2)B的相对分子质量为104,分子中含苯环且能使溴的四氯化碳溶液褪色。
(3)C的相对分子质量为78,且分子中只有一种氢原子。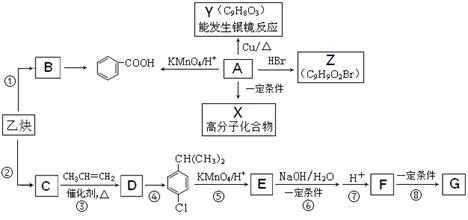
(1)写出乙炔分子的电子式_________, F中的含氧官能团名称_____________;
(2)上述①至⑧的反应中,属于加成反应的有____________,
第④步反应所需的试剂和条件是_____________;
(3)写出A的结构简式_________________;
(4)下列有关的描述中,正确的是__________;
a.1molB最多能与4molH2加成
b.B通过氧化反应可使溴水和酸性KMnO4溶液褪色
c.B、C、D是同系物
d.A→X的反应属于缩聚反应
(5)写出F→G反应的化学方程式___________________________________。