氮及其化合物在工农业生产、生活中有者重要作用。请回答下列问题: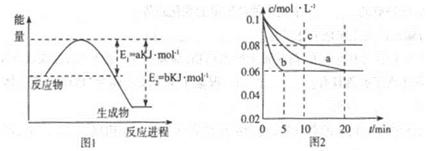
(1)图1是1molNO2和1molCO反应生成CO2和NO过程中能星变化示意图(a、b均大于0,)且知:2CO(g)+2NO(g)=N2(g)+2CO2(g)△H=-ckJ·mol-1(c>0)
请写出CO将NO2还原至N2时的热化学方程式____________;
(2)图2是实验室在三个不同条件的密闭容器中合成氨时,N2的浓度随时间的变化曲线(以a、b、c表示)。已知三个条件下起始加入浓度均为:c(N2)=0.1mol·L-1,c(H2)=0.3mol·L-1;合成氨的反应:N2(g)+3H2(g) 2NH3(g)△H<0
2NH3(g)△H<0
①计算在a达平衡时H2的转化率为______;
②由图2可知,b、c各有一个条件与a不同,则c的条件改变可能是______;
试写出判断b与a条件不同的理由____________;
(3)利用图2中c条件下合成氨(容积固定)。已知化学平衡常数K与温度(T)的关系如下表:
①试确定K1的相对大小,K1______4.1x106(填写“>”“-”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的 是______(填序号字母)。
A.容器内NH3的浓度保持不变 B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)①NH4Cl溶液呈酸性的原因是(用离子反应方程式表示 )______。
②250C时,将pH=x氨水与pH=y的疏酸(且x+y=14,x>11)等体积混合后,所得溶液中各种离子的浓度关系正确的是
A.[SO42-]>[NH4+]>[H+]>[OH-]
B.[NH4+]>[SO42-]>[OH-]>[H+]
C.[NH4+]+[H+]>[OH-]+[SO42-]
D.[NH4+]>[SO42-]>[H+]>[OH-]
(1)下列过程中不一定释放能量的是(请填编号)
A.化合反应
B.分解反应
C.形成化学键
D.燃料燃烧,
E.酸碱中和
F.炸药爆炸
(2)等质量的下列物质分别完全燃烧,放出热量较多的是(填编号)
A.硫蒸气 B.硫固体
(3)已知:通常条件下,酸碱稀溶液中和生成1mol水放出的热量为中和热。稀溶液中1molH2SO4和NaOH恰好反应时放出QkJ热量,则其中和热为kJ/mol。
(4)已知H2和O2反应放热,且断开1molH-H、1molO=O、1molO-H键需吸收的能量分别为Q1、Q2、Q3kJ。由此可以推知下列关系正确的是(填编号)
A、Q1﹥Q3,
B、Q2﹥Q3,
C、2Q1+Q2﹤2Q3,
D、2Q1+Q2﹤4Q3
E、Q1+Q2﹥Q3
F、Q1+Q2﹤Q3
、现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| A |
有三个电子层,K、M层电子数之和等于L层电子数 |
| B |
短周期中金属性最强 |
| C |
常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D |
元素最高正价是+7价 |
(1)用化学用语回答下列问题:
B元素在周期表中的位置;
用电子式表示BD化合物的形成过程。
(2)元素D与元素A相比,非金属性较强的是D,下列表述中无法证明这一事实的是(填选项序号)。
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
d.A最高价含氧酸的酸性弱于D最高价含氧酸
e.D单质能与A的氢化物反应生成A单质
(3)X是由A、B、C、D四种元素中的某种元素组成的单质,能经下图所示的过程转化(反应条件和个别生成物已略去)。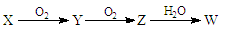
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,然后滴加适量H2O2溶液,有白色沉淀生成,生成该白色沉淀的化学方程式为:;
②若X是金属单质,则Z→W的反应中氧化剂与还原剂物质的量之比为。
(8分)由于在周期表中位置相近的元素性质相近,启发了人们在周期表中的一定区域内寻找新的物质。
(1)人们可以在周期表里金属和非金属的交界处找到半导体材料。
①下列单质中,只有一种物质不能做半导体材料,该物质是
A.Si B.Ge C.S
②Ga和As可以形成一种新型化合物半导体材料,其性能比硅更优越。Ga位于周期表的第ⅢA族,As位于周期表的第VA族。这种的新型化合物化学式为______________;
(2)致冷剂应该低毒、不易燃烧,性质稳定。致冷剂氟利昂(CF2Cl2)是科学家求助于周期表中元素及其化合物的易燃性、毒性、沸点等方面的变化趋势开发出来的。
①氢化物的易燃性:
第二周期____________>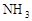 >
>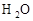 ;第三周期
;第三周期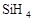 >
>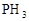 >
>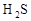 >
>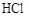 。
。
②化合物的毒性: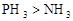
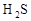 _______
_______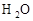
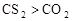
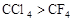
于是科学家们开始把注意力集中在含F、Cl的化合物上。经过较长时间反复试验,一种新的致冷剂氟里昂(CF2Cl2)终于诞生了。尽管现在我们知道,氟里昂导致了臭氧层的破坏,但科学家的这种研究思路还是值得肯定的。
某烃A的相对分子质量为84。回答下列问题:
(1)下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量不相等的是(填序号) 。
a.C7H12O2b.C6H14c.C6H14Od.C7H14O3
若烃A为链烃,与HBr加成后只能得到一种产物,且该烃的一氯代物只有一种。
(2)①A的结构简式为________________;名称是。
②A在一定条件下能发生加聚反应,写出该反应的化学方程式。
③A与足量的溴水反应生成B,B与NaOH的醇溶液共热可以得到D,B和D的相对分子质量满足M(D)+81=M(B)。则D分子中含有的官能团有:(填名称)。
(3)若核磁共振氢谱显示链烃A中有三个峰,且峰面积比为3:2:1。写出A所有可能的结构简式。
Ⅰ.有机物X是一种重要的有机合成中间体,用于制造塑料、涂料和粘合剂等高聚物。为研究X的组成与结构,进行了如下实验:
(1)有机物X 的质谱图为: |
(1)有机物X的相对分子质量是__________________。 |
| (2)将10.0 g X在足量O2中充分燃烧,并使其产物依次通过足量的无水CaCl2和KOH浓溶液,发现无水CaCl2增重7.2 g,KOH浓溶液增重22.0 g。 |
(2)有机物X的分子式是 __________________。 |
| (3)经红外光谱测定,有机物X中含有醛基;有机物X的核磁共振氢谱图上有2个吸收峰,峰面积之比是3︰1。 |
(3)有机物X的结构简式是 __________________。 |
Ⅱ.Diels-Alder反应为共轭双烯与含有烯键或炔键的化合物相互作用生成六元环状化合物的反应,最简单的反应是: ,
, 是由A(C5H6)和B经Diels-Alder反应制得。
是由A(C5H6)和B经Diels-Alder反应制得。
(1)Diels-Alder反应属于反应(填反应类型):A的结构简式为。
(2)写出与 互为同分异构体,且一溴代物只有两种的芳香烃的名称:;写出生成这两种一溴代物所需要的反应试剂和反应条件:。
互为同分异构体,且一溴代物只有两种的芳香烃的名称:;写出生成这两种一溴代物所需要的反应试剂和反应条件:。