一种含铝、锂、钴的电子废料中,铝以铝箔的形式存在,钴以Co3O4的形式存在(吸附在铝箔的单面或双面),锂混杂于其中。从该废料中回收Co3O4的工艺流程如下:
(1)溶液A的溶质的主要成分为 。(填化学式)
(2)钴渣中加入稀H2SO4酸化后,再加入Na2S2O3溶液可以浸出钴离子,则浸出钴离子的离子方程式为(产物中只有一种酸根) 。
(3)在实验室模拟工业生产时,也可用盐酸浸出钴离子,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴离子的主要原因: 。
(4)加入NaF的反应为:Li++F- LiF↓,该反应的平衡常数表达式为K= 。
LiF↓,该反应的平衡常数表达式为K= 。
(5)加入30%Na2CO3溶液的作用是 。
(6)在空气中锻烧CoCO3生成Co3O4的化学方程式是 。
二氧化碳的捕集、利用与封存(CCUS)是我国能源领域的一个重要战略方向,CCUS或许发展成一项重要的新兴产业。
(1)已知:CH4(g) + 2O2(g)=CO2(g) + 2H2O(g)ΔH1= a kJ•mol-1
CO(g) + H2O (g)=CO2(g) + H2(g)ΔH2= b kJ•mol-1
2CO(g) + O2(g)=2CO2(g)ΔH3 = c kJ•mol-1
反应CO2(g) + CH4(g) = 2CO(g) + 2H2(g) 的ΔH= kJ•mol-1。
(2)利用废气中的CO2为原料制取甲醇,反应方程式为:CO2+3H2  CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示。
CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示。
①a点所代表的状态________(填“是”或“不是”)平衡状态。
②c点CO2的转化率高于b点,原因是_____________________________________。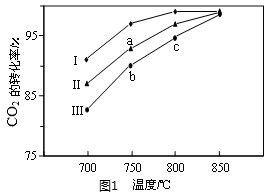
(3)在实际生产中发现,随着甲醇的生成,还伴随有少量CO副产物出现: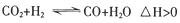 ,且CO2的转化率、甲醇的产率和CO含量除受浓度、度、压强等因素影响外,还受催化剂CuO的质量分数、气体混合物在反应锅炉内的流动速率影响(用空间流率表示)。通过实验分别得到如下数据图2、3:
,且CO2的转化率、甲醇的产率和CO含量除受浓度、度、压强等因素影响外,还受催化剂CuO的质量分数、气体混合物在反应锅炉内的流动速率影响(用空间流率表示)。通过实验分别得到如下数据图2、3: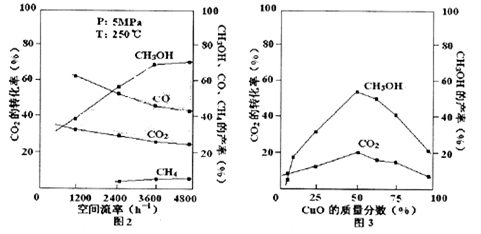
①由图2得,最佳空间流率为 h-1。
②在其他条件不变的前提下调整催化剂配比,并记录到达平衡所需的时间,得到如下表数据,试说明不选择单组份ZnO原因是 。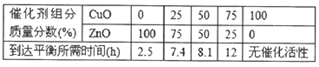
(4)用二氧化碳催化加氢来合成低碳烯烃,起始时以0.1MPa,n(H2):n(CO2)=3:1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g)  C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图4所示:
C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图4所示:
①该进行的反应的△S 0(填:“>”或“<”)。
②对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则该反应的KP= 。
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是 (列举2项)。
锌是一种常用金属,冶炼方法有火法和湿法。
I.镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似。氮化镓(GaN)是制造LED的重要材料,被誉为第三代半导体材料。
(1)Ga在元素周期表中的位置 。
(2)GaN可由Ga和NH3在高温条件下合成,该反应的化学方程式为 。
(3)下列有关镓和镓的化合物的说法正确的是 (填字母序号)。
| A.一定条件下,Ga可溶于盐酸和氢氧化钠 |
| B.常温下,Ga可与水剧烈反应放出氢气 |
| C.Ga2O3可由Ga(OH)3受热分解得到 |
| D.一定条件下,Ga2O3可与NaOH反应生成盐 |
II.工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如下图所示,回答下列问题:
已知:Fe的活泼性强于Ni
(4)ZnFe2O4可以写成ZnO·Fe2O3,写出ZnFe2O4与H2SO4反应的化学方程式 。
(5)净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,只使Fe3+转化为Fe(OH)3沉淀。净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是 。
(6)净化II中加入Zn的目的是 。
锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。
Ⅰ、ZnSO4溶液的制备与提纯:
有关资料:a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2。
(1)②中使用的氧化剂最好是下列的 (选填字母代号)。
| A.Cl2 | B.浓HNO3 | C.KMnO4 | D.H2O2 |
(2)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤
(选填①、②、③、⑤)。
(3)写出步骤④后产生滤渣3的化学式 。
(4)与Al相似,Zn也能溶于NaOH溶液。写出将Zn片和Cu片放入NaOH溶液中形成原电池的负极电极反应式 。
Ⅱ、BaS溶液的制备: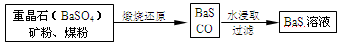
有关数据:Ba(s)+S(s)+2O2(g)=BaSO4(s) ΔH1=-1473.2 kJ·mol-1
C(s)+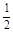 O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
Ba(s)+S(s)=BaS(s)ΔH3=-460 kJ·mol-1
(5)若煅烧还原的产物仅为BaS和CO,则其反应的热化学方程式为____________。
Ⅲ、制取锌钡白:
(6)如果生产流程步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌钡白产生的后果是_______________________。
已知A、D、E、G、L、M是核电荷数依次增大的6种短周期主族元素,其中A的原子序数与周期序数相等,D、G、L、M基态原子的最外能层均有2个未成对电子。R+核外有28个电子。请回答下列问题(用所对应的元素符号表示)。
(1)R在基态时价层电子排布式为 。
(2)写出R单质与A2G2及M最高价氧化物对应水合物反应的离子方程式 。
(3)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NGX、G3、等二次污染物。测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线放射源可用85Kr,已知Kr晶体的晶胞结构如下图所示,设晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则m/n=________(填数字)。
(4)1 mol晶体L中含有σ键的数目为________。
(5)G与M可形成MG3与MG2,MG3分子的空间构型是___________,MG2中M原子的杂化方式_________。
(6)在(EA4)2R(MG4)2中存在的化学键除极性键外,还有________(填字母)。
a.离子键b.氢键 c.配位键d.金属键
[物质结构与性质]
I.氮族元素包括N、P、As、Sb和Bi五种元素。
(1)下列关于氮族元素的说法正确的是 。
a.N2可用于填充霓虹灯,其发光原理是电子从能量较低的轨道跃迁到能量较高的轨道时以光的形式释放能量
b.P、Na、S三种元素的第一电离能由大到小的顺序是:P>S>Na
c.基态As原子中,电子占据的最高能级为4d
d.Bi原子中最外层有5个能量相同的电子
(2)NH3在水中的溶解度比PH3大得多,其原因是 。
向硫酸铜溶液中先加过量氨水,后加适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体,
该晶体中不含有的化学键是 。
A极性键 B非极性键 C离子键 D配位键 E氢键
Ⅱ. 第四周期金属与人类的生产生活息息相关。
(3)目前市售的发光二极管,其材质以砷化镓(GaAs) 为主。已知镓是与铝同族,镓的基态原子的电子排布式是 。GaAs中Ga的化合价为 。
(4)金属钛坚硬、强度大、耐热、密度小,被称为高技术金属。TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟, 则TiCl4属于 (填“原子”“分子”或“离子”)晶体。
(5) 钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种的化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,产生白色沉淀; 往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时, 产生淡黄色沉淀,则第二种配合物的化学式为 。